题目内容
某有机物A 6.2g与5.6L(标准状况)氧气充分混合点燃,恰好完全燃烧,只生成8.8g CO2和5.4g H2O.(写出必要的计算过程)
(1)试通过计算判断,有机物A中 氧(填“含有”或“不含有”).
(2)该有机物A的分子式为 .
(3)若该有机物的核磁共振氢谱中有2个吸收峰,且峰面积之比为2:1,则A的结构简式为: .
(1)试通过计算判断,有机物A中
(2)该有机物A的分子式为
(3)若该有机物的核磁共振氢谱中有2个吸收峰,且峰面积之比为2:1,则A的结构简式为:
考点:有关有机物分子式确定的计算
专题:
分析:(1)根据n=
计算氧气的物质的量,根据n=
计算CO2、H2O物质的量,根据氧原子守恒判断有机物中是否含有氧元素;
(2)结合(1)确定是否含有氧元素,确定有机物的最简式,结构最简式确定有机物的分子式;
(3)若该有机物的核磁共振氢谱中有2个吸收峰,含有两种H原子,且峰面积之比为2:1,结合(2)中有机物的分子式确定分子中氢原子数目,进而书写符合条件的有机物的结构式.
| V |
| Vm |
| m |
| M |
(2)结合(1)确定是否含有氧元素,确定有机物的最简式,结构最简式确定有机物的分子式;
(3)若该有机物的核磁共振氢谱中有2个吸收峰,含有两种H原子,且峰面积之比为2:1,结合(2)中有机物的分子式确定分子中氢原子数目,进而书写符合条件的有机物的结构式.
解答:
解:(1)5.6L(标准状况)氧气的物质的量为
=0.25mol,含有氧原子物质的量为0.25mol×2=0.5mol;
8.8g CO2的物质的量为
=0.2mol,含有氧原子物质的量为0.2mol×2=0.4mol,5.4g H2O的物质的量为
=0.3mol,含有氧原子物质的量为0.3mol,二氧化碳与水中含有氧原子的之和为0.4mol+0.3mol=0.7mol>0.5mol,故该有机物含有氧元素;
故答案为:含有;
(2)由(1)可知,6.2g有机物A含有C原子为0.2mol,含有H原子为0.3mol×2=0.6mol,含有O原子为0.7mol-0.5mol=0.2mol,故分子中C、H、O原子数目之比为:0.2mol:0.6mol:0.2mol=2:6:2,该有机物的最简式为C2H6O2,由C、H原子数目可知,H原子已经饱和,最简式即为分子式;
故答案为:C2H6O2;
(3)若该有机物的核磁共振氢谱中有2个吸收峰,含有两种H原子,且峰面积之比为2:1,含有离子氢原子数目分别为4、2,A的结构简式为:HOCH2CH2OH;
故答案为:HOCH2CH2OH.
| 5.6L |
| 22.4L/mol |
8.8g CO2的物质的量为
| 8.8g |
| 44g/mol |
| 5.4g |
| 18g/mol |
故答案为:含有;
(2)由(1)可知,6.2g有机物A含有C原子为0.2mol,含有H原子为0.3mol×2=0.6mol,含有O原子为0.7mol-0.5mol=0.2mol,故分子中C、H、O原子数目之比为:0.2mol:0.6mol:0.2mol=2:6:2,该有机物的最简式为C2H6O2,由C、H原子数目可知,H原子已经饱和,最简式即为分子式;
故答案为:C2H6O2;
(3)若该有机物的核磁共振氢谱中有2个吸收峰,含有两种H原子,且峰面积之比为2:1,含有离子氢原子数目分别为4、2,A的结构简式为:HOCH2CH2OH;
故答案为:HOCH2CH2OH.
点评:本题考查有机物分子式与结构式的确定、官能团性质等,难度不大,(2)中根据最简式确定分子式是解题关键,掌握常见官能团的性质.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40.下列说法正确的是( )
| A、B40和C70、都属于新型化合物 |
| B、C60、和N60属于同分异构体 |
| C、B40、C60、N60、C70都只含共价键 |
| D、B40、C60、N60、C70都属于烯烃 |
有关下列四个常用电化学装置的叙述中,正确的是( )
 |  | 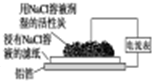 |  |
| 图Ⅰ碱性 锌锰电池 | 图Ⅱ铅硫 酸蓄电池 | 图Ⅲ铝箔的腐蚀 | 图Ⅳ银锌 纽扣电池 |
| A、图Ⅰ所示电池中,MnO2的作用是催化剂,负极反应为:Zn-2e-=Zn2+ |
| B、图Ⅱ所示电池充电过程中,硫酸浓度不断增大,阴极反应为:Pb+SO42-=PbSO4-2e- |
| C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-═Cl2↑ |
| D、图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
类推的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,因此类推出的结论最终要经过实践的检验才能确定是否正确.以下几种类推结论中正确的是( )
| A、H2SO4为强酸,推出HClO4为强酸 |
| B、CaCO3的溶解度小于Ca(HCO3)2,推出Na2CO3溶解度小于NaHCO3 |
| C、NH3的沸点高于PH3,推出CH4沸点高于SiH4 |
| D、CO2的晶体是分子晶体,推出SiO2的晶体是分子晶体 |
下列能使反应2HCl+2Ag═2AgCl+H2↑的方案是( )
A、 |
B、 |
C、 |
D、 |
下列说法不正确的是( )
| A、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| B、雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
| C、化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D、据测定,许多反应的温度每升高10K,其反应速率增加2~4倍.在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率 |
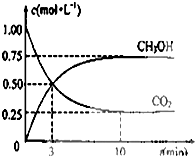 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.