题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4LH2O含有的分子总数为NA |
| B、2.4gMg与100mL1 mol?L-1盐酸溶液反应,转移电子数目为0.2NA |
| C、28g乙烯和丙烯的混合气体中所含原子总数为6NA |
| D、1mol?L-1的MgCl2溶液中含有氯离子2NA个 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况水不是气体;
B、依据n=
计算 物质的量,结合盐酸溶质物质的量分析计算过量判断,依据全部反应的物质计算电子转移;
C、乙烯和丙烯最简式相同为CH2,计算28gCH2中所含原子数;
D、溶液体积不知不能计算微粒数;
B、依据n=
| m |
| M |
C、乙烯和丙烯最简式相同为CH2,计算28gCH2中所含原子数;
D、溶液体积不知不能计算微粒数;
解答:
解:A、标准状况水不是气体,22.4LH2O物质的量不是1mol,故A错误;
B、依据n=
计算物质的量=
=0.1mol,盐酸溶质物质的量=0.1L×1mol/L=0.1mol,分析判断镁过量,依据全部反应的氯化氢计算电子转移0.1NA,故B错误;
C、乙烯和丙烯最简式相同为CH2,计算28gCH2中所含原子数=
×3×NA=6NA,故C正确;
D、溶液体积不知不能计算微粒数,故D错误;
故选C.
B、依据n=
| m |
| M |
| 2.4g |
| 24g/mol |
C、乙烯和丙烯最简式相同为CH2,计算28gCH2中所含原子数=
| 28g |
| 14g/mol |
D、溶液体积不知不能计算微粒数,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,物质结构的就放下,掌握基础是关键,题目较简单.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
能在水溶液中大量共存的一组离子是( )
| A、Fe2+、Fe3+、Na+、NO3- |
| B、Fe3+、NH4+、SCN-、Cl- |
| C、H+、I-、Na+、SiO32- |
| D、NH4+、OH-、Cl-、SO32- |
 N2(g)+3H2(g)═2NH3(g)+92.4kJ.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )
N2(g)+3H2(g)═2NH3(g)+92.4kJ.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )| A、前20分钟反应内放出的热量为46.2kJ |
| B、第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
下列物质的电子式正确的是( )
A、甲基 |
B、氯仿  |
C、羟基 |
D、乙炔 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、足量的Cu与含硫酸2mol的浓硫酸反应产生NA个SO2分子 |
| B、1mol O2在反应中作氧化剂时所得电子数一定为4NA个 |
| C、1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数均为NA个 |
| D、常温下,1L 1mol/L Na2CO3溶液中所含的碳原子数为NA个 |
 ④
④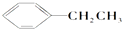
 某盐Na2R2O3?5H2O遇酸分解,具有还原性,易被氧化,化学式中两个R原子可看成处于不同价态,它是一种常用的还原剂,该盐的还原反应如下:2Na2R2O3+I2═Na2R4O6+2NaI,R2O32-的结构如图所示,判断R①和R②的价态是( )
某盐Na2R2O3?5H2O遇酸分解,具有还原性,易被氧化,化学式中两个R原子可看成处于不同价态,它是一种常用的还原剂,该盐的还原反应如下:2Na2R2O3+I2═Na2R4O6+2NaI,R2O32-的结构如图所示,判断R①和R②的价态是( )