题目内容
3.Cl2制成漂粉精的主要目的是( )| A. | 使它转化为较稳定物质,便于保存和运输 | |
| B. | 增强漂白和消毒作用 | |
| C. | 使转化为较易溶于水的物质 | |
| D. | 增加氯的质量分数,有利于漂白、消毒 |
分析 氯气是有毒气体,性质活泼,不方便保存和运输,为了方便人们日常使用和运输,需要制成漂粉精,漂粉精的主要成分是次氯酸钙和氯化钙,能够与空气中二氧化碳、水反应生成具有漂白作用、杀菌消毒的次氯酸,方便使用,据此解答.
解答 解:Cl2制成漂粉精的主要目的是:氯气是有毒气体,性质活泼,不稳定,不方便保存和运输,制成漂粉精,有利于保存和运输、使用,
故选:A.
点评 本题考查了元素化合物知识,熟悉氯气及次氯酸钙的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.下列各组离子可能大量共存的是( )
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| C. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 中性透明溶液:K+、Cl-、NO3-、Fe3+、SO42- |
11.下图有关硫元素循环说法不合理的是( )


| A. | 煤、石油中的硫元素燃烧时能生成SO2 | |
| B. | 动物尸体腐败过程产生的H2S气体会进入大气 | |
| C. | 循环过程中硫元素既发生氧化反应又发生还原反应 | |
| D. | 大气中的硫元素会全部转化成H2SO4随雨水降到土壤里 |
8.下列叙述正确的是( )
| A. | 吸热反应一定是反应物总能量大于生成物的总能量 | |
| B. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| C. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
15.下列有关FeBr2溶液的叙述错误的是( )
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 配制该溶液时,将FeBr2粉末溶解在HBr溶液中,并加入少量铁钉 |
12.将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L.则原合金样品中镁的质量为( )
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
13.常温下,在下列溶液中一定能大量共存的离子组是( )
| A. | 酸性溶液:Na+、NH4+、SO32-、NO3- | |
| B. | 滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- | |
| C. | 无色透明溶液:MnO4-、SO42-、K+、NO3- | |
| D. | 强碱性的溶液:Al3+、NH4+、Cl-、NO3- |
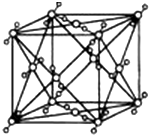 已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料. 浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下: