题目内容
12.中华文明源远流长,下面中国国宝级文物的表面不会因电化学腐蚀被氧化的是( )| A.秦朝铜车马 | B.春秋越王剑 | C.唐三彩 | D.商代司母戊鼎 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 电化学腐蚀形成的原因通常是合金在接触外界时,空气中的水膜做电解质溶液,合金中较活泼的金属做负极,不活泼的做正极,从而构成原电池,加快了活泼金属的腐蚀,据此分析.
解答 解:A、秦朝的铜车马是铜的合金,除了铜外,还含有不如铜活泼的金属,则在空气中能形成原电池,铜做负极被腐蚀,故A错误;
B、春秋越王剑是铜合金铸成,是铜合金,除了铜外,还含有不如铜活泼的金属,则在空气中能形成原电池,铜做负极被腐蚀,故B错误;
C、唐三彩是陶瓷制品,不是合金,故不会形成原电池,故C正确;
D、商代的司母戊鼎是铜鼎,是铜合金,除了铜外,还含有不如铜活泼的金属,则在空气中能形成原电池,铜做负极被腐蚀,故D错误;
故选C.
点评 本题考查了电化学腐蚀发生的条件,应注意的是通常是合金才能发生电化学腐蚀,难度不大.

练习册系列答案
相关题目
3.有人说假设与猜想是科学探究的先导和价值所在. 下列假设引导下的探究肯定没有意义的是( )
| A. | 探究Na与水的反应可能有O2生成 | |
| B. | 探究SO2和Na2O2反应可能有Na2SO4生成 | |
| C. | 探究足量的铜与一定量的浓硝酸反应的气体产物是NO还是NO2 | |
| D. | 探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致 |
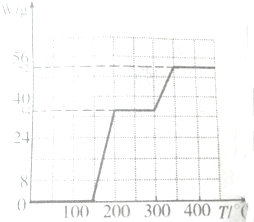
20. 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
(1)Ti的基态原子价电子排布式为3d24s2.
(2)纳米TiO2常用作下述反应的催化剂.
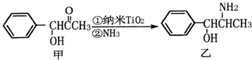
化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型是共价键、配位键,1mol该配合物中含有的σ键数目是18NA.
(4)通过X-射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如表:
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为TiN>MgO>CaO>KCl.
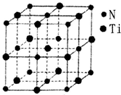
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有12个:Ti原子的配位数为6;此配位原子构成的空间构型为正八面体;该晶胞中N、Ti原子之间的最近距离为a nm.则该氮化钛晶体的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-7})^{3}}$g•cm-3、NA为阿伏加德罗常数的值,只列计算式).
 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:(1)Ti的基态原子价电子排布式为3d24s2.
(2)纳米TiO2常用作下述反应的催化剂.

化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型是共价键、配位键,1mol该配合物中含有的σ键数目是18NA.
(4)通过X-射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有12个:Ti原子的配位数为6;此配位原子构成的空间构型为正八面体;该晶胞中N、Ti原子之间的最近距离为a nm.则该氮化钛晶体的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-7})^{3}}$g•cm-3、NA为阿伏加德罗常数的值,只列计算式).
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下2.24L C12溶于水,发生反应转移的电子数一定为0.1NA | |
| B. | 1 mol的羟基(-OH)和l mol的OH-所含电子数均为1NA | |
| C. | 常温常压下,1.6gCH4中含有共价键总数为0.4NA | |
| D. | 室温下,1L 0.1mol•L-1CH3COONH4溶液中NH4+离子数为0.1NA |
17.以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备.某研究小组探究NaCl溶液对钢铁腐蚀的影响.
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上.在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如图1所示:

①实验ⅰ的现象说明,得电子的物质是O2.
②碳粉的作用是与铁组成原电池,作原电池的正极.
③为了说明NaCl的作用,需要补充的对照实验是用水代替NaCl溶液进行上述实验.
(2)向图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转.加热烧杯a,指针向右偏转.
①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作正极.
②加热后,指针发生偏转的原因可能是温度升高,Fe还原性增强,反应速率加快.
(3)用图2示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如表所示.
①Ⅱ中,b中电极发生的电极反应式是Fe-2e-=Fe2+.
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀.
查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀.设计实验证明:另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴
K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象.
(4)根据上述实验,对钢铁腐蚀有影响的因素是温度、NaCl溶液的浓度、O2的浓度.
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上.在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如图1所示:

①实验ⅰ的现象说明,得电子的物质是O2.
②碳粉的作用是与铁组成原电池,作原电池的正极.
③为了说明NaCl的作用,需要补充的对照实验是用水代替NaCl溶液进行上述实验.
(2)向图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转.加热烧杯a,指针向右偏转.
①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作正极.
②加热后,指针发生偏转的原因可能是温度升高,Fe还原性增强,反应速率加快.
(3)用图2示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如表所示.
| 实验 | a | b | 指针偏转方向 |
| Ⅰ | 0.1% | 0.01% | 向右 |
| Ⅱ | 0.1% | 3.5% | 向左 |
| Ⅲ | 3.5% | 饱和溶液 | 向右 |
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀.
查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀.设计实验证明:另取两个烧杯,分别往其中加入铁片和一定量的饱和NaCl溶液,再分别滴加几滴
K3Fe(CN)6溶液,然后往其中一个烧杯中通入O2,观察现象.
(4)根据上述实验,对钢铁腐蚀有影响的因素是温度、NaCl溶液的浓度、O2的浓度.
4.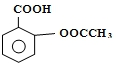 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| C. | 乙酰水杨酸的所有原子均在同一平面上 | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用硼酸溶液解毒 |