题目内容
15.下列叙述正确的是( )| A. | CH3CH2Br的沸点比CH3CH3的沸点高 | |
| B. | 所有卤代烃都能够发生水解反应和消去反应 | |
| C. | 溴乙烷与Na0H水溶液共热生成乙烯 | |
| D. | 在溴乙烷中加入AgN03溶液,立即产生淡黄色沉淀 |
分析 A.均为分子构成的物质,相对分子质量大的沸点高;
B.含1个C的卤代烃不能发生消去反应;
C.与Na0H水溶液共热,发生水解反应;
D.溴乙烷不能电离出溴离子.
解答 解:A.均为分子构成的物质,相对分子质量大的沸点高,则CH3CH2Br的沸点比CH3CH3的沸点高,故A正确;
B.含1个C的卤代烃不能发生消去反应,但卤代烃可发生水解反应,故B错误;
C.与Na0H水溶液共热,发生水解反应生成乙醇,故C错误;
D.溴乙烷不能电离出溴离子,则不能与硝酸银反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.铝和氧化铁在高温下发生的反应中,铝是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 既是氧化剂又是还原剂 |
6.标准状况下呈液态的物质为( )
| A. | Fe | B. | N2 | C. | CH3CH2OH | D. | CO |
3.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 玛瑙手饰所用材料的主要成分为硅酸盐 | |
| B. | 汽油去油污、焰色反应、煤的气化均属于物理变化 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 利用太阳能电池电解法将CO和H2O转化为甲酸的能量转化方式只有一种 |
10.下列叙述正确的是( )
| A. | 二氯甲烷有两种同分异构体 | |
| B. | 苯和苯的同系物均能使酸性高锰酸钾溶液褪色 | |
| C. | 用核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 一定条件下,溴乙烷既能发生取代反应又能发生消去反应 |
12.配制100mL0.5mol/LNaOH溶液的操作有:①计算 ②冷却 ③洗涤 ④溶解 ⑤转移 ⑥称量 ⑦定容,次序正确的是( )
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |
9. 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=2,C=50,E=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
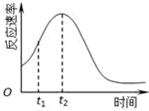
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;②产物Mn2+是反应的催化剂.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;实验中所需的定量仪器有托盘天平、250mL容量瓶、酸式滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=2,C=50,E=10
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;②产物Mn2+是反应的催化剂.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;实验中所需的定量仪器有托盘天平、250mL容量瓶、酸式滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.