题目内容
(7分)
I.Zn – MnO2干电池应用广泛,其电解质溶液是ZnCl2一NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 极(填“正”、“负”)。
(2)若ZnCl2- NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,欲除去Cu2+,最好选用下列试剂中的 (填代号)
A. NaOH B.Zn C.Fe D.NH3.H2O
Ⅱ.下图是甲烷燃料电池原理示意图,请回答下列问题:

(3)电池的正极是 (填“a”或“b”)电极,负极上的电极反应式是 。
(4)电池工作一段时间后电解质溶液的pH (填“增大”、“减小”、“不变”)
【答案】

【解析】略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
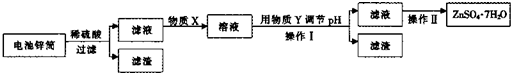
从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到纯净的硫酸锌,实验流程如下:
部分阳离子以氢氧化物形式完全沉淀时溶液的pH参见上表,请回答下列问题:
(1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有 .“酸浸”时适当补充少量水的原因是 .
(2)滤液I加入酸性KMnO4所发生反应的离子方程式为 .加入ZnO的原因是 .
(3)滤渣III的成份主要是 .
(4)从滤液III得到晶体的操作过程为 、冷却结晶、过滤冼涤、小心干燥.

| 沉淀物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Cd(OH)2 | Mn(OH)2 | pH值 | 8.0 | 9.7 | 3.2 | 6.7 | 9.4 | 10.4 |
(1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有
(2)滤液I加入酸性KMnO4所发生反应的离子方程式为
(3)滤渣III的成份主要是
(4)从滤液III得到晶体的操作过程为
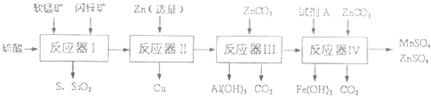
 锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).
锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).