题目内容
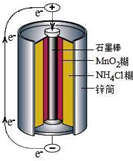
 锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).
锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).(1)干电池中NH4Cl淀粉糊的作用是
(2)干电池的负极反应式为
(3)回收废电池锌筒,进一步处理可得ZnSO4.7H20.其工业流程如下:
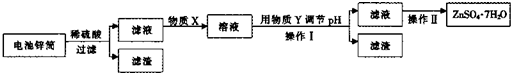
已知:
| 氢氧化物 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.7 | 8.1 | 7.6 | 6.5 | 4.7 |
| 完全沉淀的pH | 3.7 | 10.1 | 9.6 | 8.0 | 6.5 |
A?氯水 B.NaOH 溶液 C.KMnO4 溶液 D.H2O2 溶液 E O3
②在操作I前,需要调节pH的范围为
③在制备ZnSO4-7H20的工艺中,操作n为
④某同学认为要得到ZnSO4JH2O,要在操作π前的滤液中加入稀H2S04.你认为有 必要吗?答:
分析:(1)NH4Cl作电解质,提供自由移动离子;
(2)干电池中Zn失电子作负极;
(3)①X为氧化剂,把二价铁离子氧化物三价铁离子;
②调节PH使三价铁离子完全沉淀,而锌离子不能沉淀;
③根据从溶液中提取溶质的方法分析;
④ZnSO4水解产生H2SO4为难挥发性酸.
(2)干电池中Zn失电子作负极;
(3)①X为氧化剂,把二价铁离子氧化物三价铁离子;
②调节PH使三价铁离子完全沉淀,而锌离子不能沉淀;
③根据从溶液中提取溶质的方法分析;
④ZnSO4水解产生H2SO4为难挥发性酸.
解答:解:(1)NH4Cl作电解质,提供自由移动离子,故答案为:电解质;
(2)干电池中Zn失电子作负极,其反应方程式为:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(3)①X为氧化剂,把二价铁离子氧化物三价铁离子,加入的氧化剂还不能引入杂质,所以选用H2O2溶液或O3,故答案为:D、E;
②调节PH使三价铁离子完全沉淀,而锌离子不能沉淀,由表中数据可知三价铁离子完全沉淀时PH为3.7,而锌开始沉淀时PH为6.5,所以需要调节pH的范围为3.7≤pH<6.5,故答案为:3.7≤pH<6.5;
③从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
④ZnSO4水解产生H2SO4为难挥发性酸,所以不必要加入稀H2S04,故答案为:不必要;ZnSO4水解产生Zn(OH)2和H2SO4,H2SO4为难挥发性酸,由于H2SO4不离开溶液体系,溶液结晶时又重新转化为ZnSO4.
(2)干电池中Zn失电子作负极,其反应方程式为:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(3)①X为氧化剂,把二价铁离子氧化物三价铁离子,加入的氧化剂还不能引入杂质,所以选用H2O2溶液或O3,故答案为:D、E;
②调节PH使三价铁离子完全沉淀,而锌离子不能沉淀,由表中数据可知三价铁离子完全沉淀时PH为3.7,而锌开始沉淀时PH为6.5,所以需要调节pH的范围为3.7≤pH<6.5,故答案为:3.7≤pH<6.5;
③从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
④ZnSO4水解产生H2SO4为难挥发性酸,所以不必要加入稀H2S04,故答案为:不必要;ZnSO4水解产生Zn(OH)2和H2SO4,H2SO4为难挥发性酸,由于H2SO4不离开溶液体系,溶液结晶时又重新转化为ZnSO4.
点评:本题考查了干电池的电极反应,从负极材料中提取ZnSO4.7H20的操作,题目难度一般.

练习册系列答案
相关题目
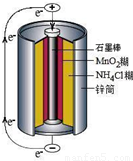
锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
NH3↑+H2O
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |

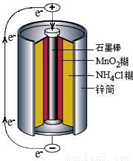
锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
NH3↑+H2O
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |


 锌锰干电池是最早使用的化学电池,其基本构造如图所示.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.