题目内容
10.25℃时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,该溶液中一定不能大量共存的离子组是( )| A. | NH4+、Fe3+、SO42-、Cl- | B. | CO32-、PO43-、K+、Na+ | ||
| C. | Na+、SO42-、NO3-、Cl- | D. | HCO3-、Na+、HSO3-、K+ |
分析 25°C时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,为酸或碱溶液,与氢离子或氢氧根离子均不反应的离子,能大量共存,
A.铵根离子、铁离子都不与氢离子反应;
B.四种离子都不与氢氧根离子反应;
C.四种离子之间不反应,都不与酸和碱溶液反应,能够大量共存;
D.碳酸氢根离子、亚硫酸氢根离子都与酸溶液和碱溶液反应.
解答 解:25°C时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,为酸或碱溶液,
A.因碱溶液中不能大量存在NH4+、Fe3+,但在酸溶液中不反应能共存,故A错误;
B.因酸溶液中不能大量存在CO32-,碱溶液中不反应能共存,故B错误;
C.因酸或碱溶液中Na+、SO42-、NO3-、Cl-均不反应,能大量共存,故C错误;
D.HCO3-、HSO3-既能与酸反应又能与碱反应,一定不能共存,故D正确;
故选D.
点评 本题考查离子的共存,为高考常见题型,把握信息的抽取及离子之间的反应即可解答,侧重复分解反应的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.X、Y、Z、W、R是短周期中的常见元素,其相关信息如表:
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是Na>Al>N>O(用元素符号表示).
(2)Y2电子式为 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为33,其最高价氧化物的化学式为As2O5.该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3(用化学式表示).
(4)W在元素周期表中的位置为第三周期第ⅠA族,能够说明W和R金属性强弱的依据有cd.
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑.
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
(2)Y2电子式为
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为33,其最高价氧化物的化学式为As2O5.该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3(用化学式表示).
(4)W在元素周期表中的位置为第三周期第ⅠA族,能够说明W和R金属性强弱的依据有cd.
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑.
18.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 26g的苯和乙炔的混合物最多可以与2mol的氢气发生加成 | |
| B. | 某温度下,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为1NA |
19.下列有关臭氧的说法中,正确的是( )
| A. | 常温常压下,臭氧和氧气都是无色气体 | |
| B. | 臭氧与氧气可以相互转化,其反应属于氧化还原反应 | |
| C. | 臭氧具有极强的氧化性,可以将 Ag、Hg 等不活泼金属氧化 | |
| D. | 臭氧是一种很好的消毒剂,空气中存在大量的臭氧有利于人体健康 |
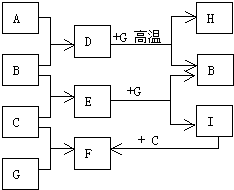 单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去).
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去).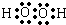 ;
;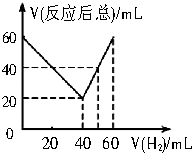 某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )
某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )