题目内容
NA代表阿伏伽德罗常数,下列叙述错误的是( )
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,1 L 0.50 mol?L-1NH4Cl溶液与2 L 0.25mol?L-1NH4Cl溶液含NH4+物质的量不同 |
考点:阿伏加德罗常数
专题:
分析:A、根据浓硫酸与稀硫酸的密度不同,稀释后硫酸的质量分数大于9.8%;
B、反应中只有氧元素的化合价升高由-1升高到0价,只有氯元素的化合价降低由0价降低到-1价,氧气由氧元素组成,32g为氧原子质量,根据n=
计算氧原子的物质的量,再根据N=nNA计算转移电子数目;
C、依据气体摩尔体积的条件应用,结合一氧化碳和乙烯的摩尔质量相同分析计算;
D、铵根离子浓度越大,水解程度越小,据此进行判断两溶液中铵根离子浓度大小.
B、反应中只有氧元素的化合价升高由-1升高到0价,只有氯元素的化合价降低由0价降低到-1价,氧气由氧元素组成,32g为氧原子质量,根据n=
| m |
| M |
C、依据气体摩尔体积的条件应用,结合一氧化碳和乙烯的摩尔质量相同分析计算;
D、铵根离子浓度越大,水解程度越小,据此进行判断两溶液中铵根离子浓度大小.
解答:
解:A、10mL质量分数为98%的H2SO4,用水稀释至100mL,由于硫酸溶液的密度大于水的密度,所以稀释后H2SO4的质量分数大于9.8%,故A错误;
B、生成32g氧气,则转移电子数为
×1×NAmol-1=2NA,故B正确;
C、标准状况下,分子数为NA的CO、C2H4混合气体物质的量为1mol,体积约为22.4L,CO、C2H4的摩尔质量相同都为28g/mol,所以质量为28g,故C正确;
D、一定温度下1L 0.50mol?L-1NH4Cl溶液中含有溶质氯化铵0.5mol;2L 0.25mol?L-1NH4Cl溶液中含有溶质氯化铵0.5mol;两溶液中溶质氯化铵的物质的量相同,铵根离子浓度不同,铵根离子的水解程度不同,所以溶液中含NH4+的物质的量不同,故D正确;
故选A.
B、生成32g氧气,则转移电子数为
| 32g |
| 16g/mol |
C、标准状况下,分子数为NA的CO、C2H4混合气体物质的量为1mol,体积约为22.4L,CO、C2H4的摩尔质量相同都为28g/mol,所以质量为28g,故C正确;
D、一定温度下1L 0.50mol?L-1NH4Cl溶液中含有溶质氯化铵0.5mol;2L 0.25mol?L-1NH4Cl溶液中含有溶质氯化铵0.5mol;两溶液中溶质氯化铵的物质的量相同,铵根离子浓度不同,铵根离子的水解程度不同,所以溶液中含NH4+的物质的量不同,故D正确;
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
居室空气污染物达300多种,其中有一种来自人造地板、家具以及装修粘合剂,长期接触可引起过敏性皮炎、免疫功能异常.该污染物是( )
| A、甲醛(HCHO) |
| B、CO |
| C、氡(Rn) |
| D、NO2 |
反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A、v(A)=0.15 mol?L-1?min-1 |
| B、v(B)=0.015 mol?L-1?s-1 |
| C、v(C)=0.40 mol?L-1?min-1 |
| D、v(D)=0.45 mol?L-1?min-1 |
下列说法中(NA代表阿伏加德罗常数的值),不正确的是( )
| A、标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| B、常温下,2.3g Na完全与O2反应失去的电子数为0.1NA |
| C、100mL 18.4mol?L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92 NA |
| D、在密闭容器中加入1.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
下列离子反应方程式,书写正确的是( )
| A、碳酸氢钠溶液中加入醋酸:CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钠溶液中加入硫酸:H++OH-=H2O |
下列物质中属于有机物的是( )
| A、甲醇 | B、苏打 | C、水泥 | D、玻璃 |
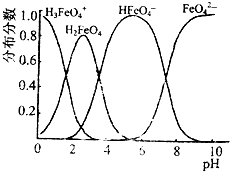 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
 某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下: