题目内容
 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:(1)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2.由此看来,高铁酸钠能够杀菌消毒是因为它具有
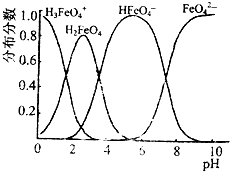
(3)FeO42-在水溶液中的存在形态如图所示.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH 则电池正极材料是
考点:原电池和电解池的工作原理,氧化还原反应,盐类水解的原理
专题:
分析:(1)根据原子守恒来分析判断;
(2)具有氧化性物质能够杀菌消毒,氢氧化铁胶体具有吸附性;
(3)加KOH溶液HFeO4-减少,FeO42-增加;
(4)放电时,该电池是原电池,原电池负极上失电子化合价升高而发生氧化反应,正极上得电子;充电时为电解池,正极与外接电源的正极相连为阳极.
(2)具有氧化性物质能够杀菌消毒,氢氧化铁胶体具有吸附性;
(3)加KOH溶液HFeO4-减少,FeO42-增加;
(4)放电时,该电池是原电池,原电池负极上失电子化合价升高而发生氧化反应,正极上得电子;充电时为电解池,正极与外接电源的正极相连为阳极.
解答:
解:(1)2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O反应中存在原子守恒,则X为NaCl,故答案为:NaCl;
(2)高铁酸钠具有氧化性物质能够杀菌消毒,生成的三价铁离子水解生成氢氧化铁胶体,氢氧化铁胶体具有吸附性,可以吸附水中的悬浮杂质,
故答案为:强氧化;氢氧化铁胶体具有吸附性,可以吸附水中的悬浮杂质;
(3)向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故答案为:HFeO4-+OH-=FeO42-+H2O;
(4)放电时,该电池是原电池,原电池负极上Zn失电子,负极反应为Zn-2e-+2OH-═Zn(OH)2,正极上K2FeO4得电子;充电时为电解池,正极与外接电源的正极相连为阳极,阳极失电子发生氧化反应,
故答案为:K2FeO4;失;Zn-2e-+2OH-═Zn(OH)2.
(2)高铁酸钠具有氧化性物质能够杀菌消毒,生成的三价铁离子水解生成氢氧化铁胶体,氢氧化铁胶体具有吸附性,可以吸附水中的悬浮杂质,
故答案为:强氧化;氢氧化铁胶体具有吸附性,可以吸附水中的悬浮杂质;
(3)向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故答案为:HFeO4-+OH-=FeO42-+H2O;
(4)放电时,该电池是原电池,原电池负极上Zn失电子,负极反应为Zn-2e-+2OH-═Zn(OH)2,正极上K2FeO4得电子;充电时为电解池,正极与外接电源的正极相连为阳极,阳极失电子发生氧化反应,
故答案为:K2FeO4;失;Zn-2e-+2OH-═Zn(OH)2.
点评:本题考查了铁及其化合物的性质、胶体的性质、原电池和电解池原理的应用等,题目难度中等,明确铁的性质是解题关键,注意物质净水的原理和原电池、电解池原理.

练习册系列答案
相关题目
能够用来鉴别乙醇、乙酸和苯的物质是( )
| A、紫色石蕊试液 | B、氢氧化钠溶液 |
| C、金属钠 | D、水 |
下列有关氧化还原反应说法正确的是( )
| A、工业制硫酸、工业制硝酸、由石英获取单晶硅变化均为氧化还原反应 |
| B、氧化反应与还原反应一定同时发生,但氧化剂、还原剂可不直接接触 |
| C、置换反应肯定都是氧化还原反应,但复分解反应可能是氧化还原反应 |
| D、氧化还原反应中氧化产物与还原产物不会再发生氧化还原反应 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B、脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D、金属的电化学腐蚀普遍存在,工业上经常用牺牲阳极的阴极保护法对金属进行保护,这是电解原理的一个重要应用 |
能证明淀粉已经完全水解的试剂是( )
| A、碘化钾溶液 | B、银氨溶液 |
| C、碘水 | D、酚酞试剂 |
下列反应中属于放热反应的是( )
| A、电解Al2O3得到Al和O2 |
| B、石灰石高温分解为生石灰和二氧化碳 |
| C、铝粉与氧化铁高温反应 |
| D、Ba(OH)2?8H2O和NH4Cl晶体混合反应 |
 X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生右图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生右图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )| A、X元素位于ⅥA |
| B、A不能溶解于B中 |
| C、B的沸点高于C的沸点 |
| D、A和C不可能发生氧化还原反应 |
NA代表阿伏伽德罗常数,下列叙述错误的是( )
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,1 L 0.50 mol?L-1NH4Cl溶液与2 L 0.25mol?L-1NH4Cl溶液含NH4+物质的量不同 |