��Ŀ����
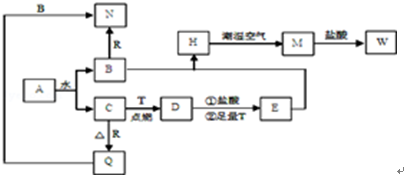
������һ����ɫ��Դ��һ��Ŀǰ����ķ��������õ����Ȼ�ѧѭ���Ʊ���������ԭ��ʾ��ͼ��ͼ1��
��1����֪��SO3��g��?SO2��g��+
O2��g����H1=-98.3kJ?mol-1
H2SO4��l��?SO3��g��+H2O��l����H2=-130.4kJ?mol-1
2H2SO4��l��?2SO2��g��+O2��g��+2H2O��l����H3
���H3= kJ?mol-1��
��2�������Ȼ�ѧѭ������Ҫ���Ĵ���������������Դ�Ƕȿ��ǣ��ɲ��õĽ�������� ��
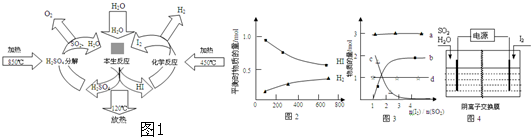
��3���⻯���ȷֽⷴӦΪ��2HI��g��?H2��g��+I2��g�����ֽ�������ͼ2���ֽⷴӦƽ�ⳣ������ʽΪ��K= �������¶�ʱƽ�ⳣ��K ��ѡ�������С������
��4��������Bunsen����Ӧ��SO2��I2��H2O�����ķ�ӦΪ��SO2+I2+2H2O=3H++HSO4-+2I-��I-+I2?I3-��
�ٵ���ʼʱ��SO2Ϊ1mol��ˮΪ16mol����Һ�и����ӱ仯��ϵ��ͼ3��ͼ��b�仯��ʾ�������� ����ˮ���н��еı�����Ӧ����ʹˮ�͵�������������������Ӧ����Ӧ�������ȣ�д��Ũ������HI������Ӧ������͵�Ļ�ѧ����ʽ ��
��Ұ�壨Nonura������������õ��ķ������б�����Ӧ����Ӧԭ����ͼ4��ʾ���������ĵ缫��ӦʽΪ ��
��1����֪��SO3��g��?SO2��g��+
| 1 |
| 2 |
H2SO4��l��?SO3��g��+H2O��l����H2=-130.4kJ?mol-1
2H2SO4��l��?2SO2��g��+O2��g��+2H2O��l����H3
���H3=
��2�������Ȼ�ѧѭ������Ҫ���Ĵ���������������Դ�Ƕȿ��ǣ��ɲ��õĽ��������
��3���⻯���ȷֽⷴӦΪ��2HI��g��?H2��g��+I2��g�����ֽ�������ͼ2���ֽⷴӦƽ�ⳣ������ʽΪ��K=
��4��������Bunsen����Ӧ��SO2��I2��H2O�����ķ�ӦΪ��SO2+I2+2H2O=3H++HSO4-+2I-��I-+I2?I3-��
�ٵ���ʼʱ��SO2Ϊ1mol��ˮΪ16mol����Һ�и����ӱ仯��ϵ��ͼ3��ͼ��b�仯��ʾ��������
��Ұ�壨Nonura������������õ��ķ������б�����Ӧ����Ӧԭ����ͼ4��ʾ���������ĵ缫��ӦʽΪ

���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧƽ���Ӱ������,��ѧƽ��ĵ�������,���ԭ��
ר�⣺
��������1�����ݸ�˹���ɼ��㣻
��2������Դ�Ƕȿ��ǣ���̫���ܡ����ܡ����ܼ��������ܵ���Ϊ��Դ��
��3���ٸ���ƽ�ⳣ������ʽ����������Ũ�ȵ��ݴη�֮�����Ϸ�Ӧ��Ũ�ȵ��ݴη�֮����д��
��ͼ�������¶ȣ��������÷�Ӧ������Ӧ�����ƶ�����ƽ�ⳣ������
��4���ٸ���ͼ��bΪ����Խ��Խ������ӣ�����������ԭ��Ӧ��ʧ�����غ���дŨ������HI������Ӧ������͵�Ļ�ѧ����ʽ��
�ڸ�������ʧ���ӻ��ϼ����߷���������Ӧ����д��
��2������Դ�Ƕȿ��ǣ���̫���ܡ����ܡ����ܼ��������ܵ���Ϊ��Դ��
��3���ٸ���ƽ�ⳣ������ʽ����������Ũ�ȵ��ݴη�֮�����Ϸ�Ӧ��Ũ�ȵ��ݴη�֮����д��
��ͼ�������¶ȣ��������÷�Ӧ������Ӧ�����ƶ�����ƽ�ⳣ������
��4���ٸ���ͼ��bΪ����Խ��Խ������ӣ�����������ԭ��Ӧ��ʧ�����غ���дŨ������HI������Ӧ������͵�Ļ�ѧ����ʽ��
�ڸ�������ʧ���ӻ��ϼ����߷���������Ӧ����д��
���
�⣺��1����֪����SO3��g��?SO2��g��+
O2��g����H1=-98.3kJ?mol-1
��H2SO4��l��?SO3��g��+H2O��l����H2=-130.4kJ?mol-1
��١�2+�ڡ�2�ã�2H2SO4��l��?2SO2��g��+O2��g��+2H2O��l����H3=-2��98.3kJ?mol-1-2��130.4kJ?mol-1
=-457.4kJ?mol-1���ʴ�Ϊ��-457.4��
��2������Դ�Ƕȿ��ǣ���̫���ܡ����ܡ����ܼ��������ܵ���Ϊ��Դ���ʴ�Ϊ����̫���ܡ����ܡ����ܼ��������ܵ���Ϊ��Դ��
��3������2HI��g��?H2��g��+I2��g������K=
����ͼ�������¶ȣ��������÷�Ӧ������Ӧ�����ƶ�����ƽ�ⳣ������
�ʴ�Ϊ��
������
��4������ͼ��bΪ����Խ��Խ������ӣ������SO2+I2+2H2O=3H++HSO4-+2I-��I-+I2?I3-����Ӧ��Խ��Խ�������ΪI3-����������ԭ��Ӧ��ʧ�����غ㣬��Ũ������HI������Ӧ������͵�Ļ�ѧ����ʽΪ 6HI+H2SO4��Ũ��=3I2��+S��+4H2O��
�ʴ�Ϊ��I3-��6HI+H2SO4��Ũ��=3I2��+S��+4H2O��
��������ʧ���ӻ��ϼ����߷���������Ӧ�����������������ʧ�����������������ӦʽΪ��SO2+2H2O-2e-=4H++SO42-���ʴ�Ϊ��SO2+2H2O-2e-=4H++SO42-��
| 1 |
| 2 |
��H2SO4��l��?SO3��g��+H2O��l����H2=-130.4kJ?mol-1
��١�2+�ڡ�2�ã�2H2SO4��l��?2SO2��g��+O2��g��+2H2O��l����H3=-2��98.3kJ?mol-1-2��130.4kJ?mol-1
=-457.4kJ?mol-1���ʴ�Ϊ��-457.4��
��2������Դ�Ƕȿ��ǣ���̫���ܡ����ܡ����ܼ��������ܵ���Ϊ��Դ���ʴ�Ϊ����̫���ܡ����ܡ����ܼ��������ܵ���Ϊ��Դ��
��3������2HI��g��?H2��g��+I2��g������K=
| c(H 2)c(I 2) |
| c 2(HI) |
�ʴ�Ϊ��
| c(H 2)c(I 2) |
| c 2(HI) |
��4������ͼ��bΪ����Խ��Խ������ӣ������SO2+I2+2H2O=3H++HSO4-+2I-��I-+I2?I3-����Ӧ��Խ��Խ�������ΪI3-����������ԭ��Ӧ��ʧ�����غ㣬��Ũ������HI������Ӧ������͵�Ļ�ѧ����ʽΪ 6HI+H2SO4��Ũ��=3I2��+S��+4H2O��
�ʴ�Ϊ��I3-��6HI+H2SO4��Ũ��=3I2��+S��+4H2O��
��������ʧ���ӻ��ϼ����߷���������Ӧ�����������������ʧ�����������������ӦʽΪ��SO2+2H2O-2e-=4H++SO42-���ʴ�Ϊ��SO2+2H2O-2e-=4H++SO42-��
������������Ҫ�����˸�˹���ɵ�Ӧ�ã�ƽ�ⳣ���ı���ʽ�����ж��Լ����ص�ԭ�����ѶȲ���ע�ⷽ��ʽ����д��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
����ɫ������Һ�п��Դ���������������� ��������
| A��H+��K+��HCO3-��NO3- |
| B��OH-��Cl-��Na+��NH4+ |
| C��Cu2+��NO3-��OH-��Cl- |
| D��Mg2+��K+��Cl-��NO3- |
���л�ѧ������ȷ���ǣ�������
A��CO2���ӵı���ģ�ͣ� |
B��NH4Br�ĵ���ʽ�� |
C����̬Feԭ�ӵ�ԭ�ӽṹʾ��ͼ�� |
D����̬Alԭ�ӵļ۵����Ų�ͼ�� |
��֪��C ��s��+O2��g��=CO��g����H=-110.50KJ/mol
C ��s��+O2��g��=CO2��g����H=-393.51KJ/mol
��ӦC ��s��+CO2��g��=2CO��g���ġ�HΪ��������
C ��s��+O2��g��=CO2��g����H=-393.51KJ/mol
��ӦC ��s��+CO2��g��=2CO��g���ġ�HΪ��������
| A��-283.01KJ/mol |
| B��+172.51 KJ/mol |
| C��+283.01KJ/mol |
| D��-504.01 KJ/mol |
����˵����ȷ���ǣ�������
| A��Ǧ�����ڷŵ�����У�����������С�������������� |
| B������ѡ�H2+Cl2�T2HCl����Ƴ�ȼ�ϵ�أ����ڹ�ҵ�����ᣬ�����з��� |
| C����п��ϡ���ᷴӦ�������������ʽ������ټ�������CuSO4���壬���ʲ��� |
| D��ԭ��ص�����һ�����ɻ����Բ�ͬ�����ֽ������ |