题目内容
 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去).请填空:(1)若D是生产、生活中用量最大、用途最广的金属单质,A是黄绿色气体,请写出C的化学式
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为
(3)若D为酸或酸性气体,则A、C可以是
(4)若B为淡黄色晶体,则反应③的化学方程式为
考点:无机物的推断
专题:推断题
分析:(1)若D是生产、生活中用量最大、用途最广的金属单质,应为Fe,A是黄绿色气体,应为Cl2,则B为FeCl3,C为FeCl2;
(2)若A用作制冷剂,则A是氨气,B和D为空气的主要成分,D是氧气,B是氮气,C为NO;
(3)若D为酸或酸性气体,A能与酸性气体反应生成两种不同的化合物,则A、C可以NaOH、NaHCO3 或NaOH、NaHSO3或Fe、Fe(NO3)3;
(4)若B为淡黄色晶体,应为S,则A为H2S,C为SO2,D为O2.
(2)若A用作制冷剂,则A是氨气,B和D为空气的主要成分,D是氧气,B是氮气,C为NO;
(3)若D为酸或酸性气体,A能与酸性气体反应生成两种不同的化合物,则A、C可以NaOH、NaHCO3 或NaOH、NaHSO3或Fe、Fe(NO3)3;
(4)若B为淡黄色晶体,应为S,则A为H2S,C为SO2,D为O2.
解答:
解:(1)若D是生产、生活中用量最大、用途最广的金属单质,应为Fe,A是黄绿色气体,应为Cl2,则B为FeCl3,C为FeCl2,故答案为:FeCl2;
(2)若A用作制冷剂,则A是氨气,B和D为空气的主要成分,D是氧气,B是氮气,C为NO,反应②的化学方程式为N2+O2
2NO,故答案为:N2+O2
2NO;
(3)若D为酸或酸性气体,A能与酸性气体反应生成两种不同的化合物,说明是A2不同会生成不同产物,结合物质性质分析A、C可能的物质为:
NaOH
Na2CO3(Na2SO3)
NaHCO3(NaHSO3),
Fe
FeCl2
FeCl3,
NaAl(OH)4
Al(OH)3
AlCl3,
CaO
CaCO3
Ca(HCO3)2,
Na2O2
NaCO3
NaHCO3,
故答案为:NaOH、NaHCO3或Fe、Fe(NO3)3或Na[Al(OH)4]、AlCl3或CaO、Ca(HCO3)2、CO2或Na2O2、NaHCO3等;
(4)若B为淡黄色晶体,应为S,则A为H2S,C为SO2,D为O2,反应③的化学方程式为2H2S+SO2═3S↓+2H2O,故答案为:2H2S+SO2═3S↓+2H2O.
(2)若A用作制冷剂,则A是氨气,B和D为空气的主要成分,D是氧气,B是氮气,C为NO,反应②的化学方程式为N2+O2
| ||
| ||
(3)若D为酸或酸性气体,A能与酸性气体反应生成两种不同的化合物,说明是A2不同会生成不同产物,结合物质性质分析A、C可能的物质为:
NaOH
| CO2或SO2 |
| CO2或SO2 |
Fe
| HNO3 |
| HNO3 |
NaAl(OH)4
| HCl |
| HCl |
CaO
| CO2 |
| CO2 |
Na2O2
| CO2 |
| CO2 |
故答案为:NaOH、NaHCO3或Fe、Fe(NO3)3或Na[Al(OH)4]、AlCl3或CaO、Ca(HCO3)2、CO2或Na2O2、NaHCO3等;
(4)若B为淡黄色晶体,应为S,则A为H2S,C为SO2,D为O2,反应③的化学方程式为2H2S+SO2═3S↓+2H2O,故答案为:2H2S+SO2═3S↓+2H2O.
点评:本题考查较为综合,涉及元素化合物的推断,为高频考点,侧重于学生的分析能力,物质性质是解题关键,题目具有一定难度,做题时注意把握推断的思路.

练习册系列答案
相关题目
以下记录的数据不符合实验事实的是( )
| A、用量筒量取3.3mL蒸馏水 |
| B、用广泛pH试纸测得某溶液的pH为7.2 |
| C、用滴定管量取20.00mL NaOH溶液 |
| D、用电子天平称取2.100g NaCl固体 |
下列有机反应表达错误的是( )
A、CH4+Cl2
| |||
| B、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
C、
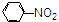 | |||
D、nCH2=CH2
 |
下列有关物理量相应的单位表达中,错误的是( )
| A、气体摩尔体积L/g |
| B、摩尔质量g/mol |
| C、物质的量浓度mol/L |
| D、物质的量 mol |
 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.