题目内容
 A、B、C、D、E是原子序数依次增大的前四周期元素,其信息如表:
A、B、C、D、E是原子序数依次增大的前四周期元素,其信息如表:| 元素 | 相关信息 |
| A | 最外层电子数是次外层的2倍 |
| B | 是空气中含量最丰富的元素 |
| C | P轨道上有2个未成对电子 |
| D | 是地壳中含量最多的金属元素 |
| E | 常用来制电线、电缆 |
(2)C与D形成的化合物晶体类型是
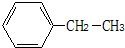
(3)A的一种氢化物对H2的相对密度为14,其分子中所含σ键的数目为
(4)E的基态原子核外电子排布式是
(5)已知:
①对于反应体系所有物质全为气体的反应,反应焓变可用键能来估算:
②H2O(l)=H2O(g)△H=+44kJ/mol
③H-H和H-C的键能分别为436.0kJ/mol和462.8kJ/mol
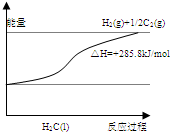
④C的氢化物分解的能量变化如图,
则C2分子中的键能为
考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用,反应热和焓变
专题:化学反应中的能量变化,元素周期律与元素周期表专题
分析:A、B、C、D、E是原子序数依次增大的前四周期元素,A的最外层电子数是次外层的2倍,可推断A为C元素;B是空气中含量最丰富的元素,可推断B为N元素;C的P轨道上有2个未成对电子O元素;D是地壳中含量最多的金属元素,可推断D为Al元素;E常用来制电线、电缆,可推断E为Cu元素.以此解答本题各小问.
解答:
解:A、B、C、D、E依次为C元素、N元素、O元素、Al元素、Cu元素,
(1)同主族自上而下第一电离能逐渐减小,同周期自左而右第一电离能呈增大趋势,N元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;具有相同电子层数的离子,电荷数越大离子半径越小,即r(Al3+)<r(O2-)<r(N3-);
故答案为:N;r(Al3+)<r(O2-)<r(N3-);
(2)O与Al形成的氧化铝是金属氧化物,属于离子晶体;氧化铝是两性氧化物,和氢氧化钠反应生成AlO2-和H2O,其反应方程式为Al2O3+2OH-═2AlO2-+H2O;
故答案为:离子晶体;Al2O3+2OH-═2AlO2-+H2O;
(3)A的一种氢化物的摩尔质量=14×2g/mol=28g/mol,可知A为CH2=CH2,4个C-H键及碳碳双键中的一个键为σ键;原子半径越小共价键键能越大,同周期元素由左到右原子半径逐渐减小,所以键能顺序为:H-O>H-N>H-C;
故答案为:5;H-O>H-N>H-C;
(4)Cu原子核外有29个电子,根据构造原理Cu的电子排布式为1s22s22p63s23p63d104s1;
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);
(5)由H2O(l)=H2O(g)△H=+44kJ/mol和H2O(l)=H2+
O2(g)△H=+285.8kJ/mol得H2O(g)=H2+
O2(g)△H=+241.8kJ/mol,再由H-H和H-O的键能分别为436.0kJ/mol和462.8kJ/mol,设O2的键能为x,可得2×462.8kJ/mol-436.0kJ/mol-
x=241.8KJ/mol,解得x=495.6kJ/mol.
故答案为:495.6kJ/mol.
(1)同主族自上而下第一电离能逐渐减小,同周期自左而右第一电离能呈增大趋势,N元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;具有相同电子层数的离子,电荷数越大离子半径越小,即r(Al3+)<r(O2-)<r(N3-);
故答案为:N;r(Al3+)<r(O2-)<r(N3-);
(2)O与Al形成的氧化铝是金属氧化物,属于离子晶体;氧化铝是两性氧化物,和氢氧化钠反应生成AlO2-和H2O,其反应方程式为Al2O3+2OH-═2AlO2-+H2O;
故答案为:离子晶体;Al2O3+2OH-═2AlO2-+H2O;
(3)A的一种氢化物的摩尔质量=14×2g/mol=28g/mol,可知A为CH2=CH2,4个C-H键及碳碳双键中的一个键为σ键;原子半径越小共价键键能越大,同周期元素由左到右原子半径逐渐减小,所以键能顺序为:H-O>H-N>H-C;
故答案为:5;H-O>H-N>H-C;
(4)Cu原子核外有29个电子,根据构造原理Cu的电子排布式为1s22s22p63s23p63d104s1;
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);
(5)由H2O(l)=H2O(g)△H=+44kJ/mol和H2O(l)=H2+
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:495.6kJ/mol.
点评:本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列食物中富含维生素的是( )
| A、馒头 | B、可口可乐 | C、甘蔗 | D、橙 |
造成世界有名的“八大公害”事件中,污染事件发生最多的是( )
| A、水污染 | B、食品污染 |
| C、大气污染 | D、重金属污染 |