题目内容
10.实验室用固体烧碱配制0.1 mol•L-1的NaOH溶液500 mL,回答下列问题:(1)计算需要NaOH固体的质量2.0g
(2)在配制的过程中,下列操作出现的后果是 (填:“偏低”、“偏高”、“无影响”):
①发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线偏低
②配制氯化钠溶液,定容时俯视容量瓶刻度线偏高
③定容摇匀后液面下降低于刻度线无影响.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$判断误差,凡是使n偏大或者使V偏小的操作,溶液浓度都偏大,反之溶液浓度偏小,据此分析解答.
解答 解:(1)固体烧碱配制0.1 mol•L-1的NaOH溶液500 mL,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(2)①发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线,导致溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏低;
②配制氯化钠溶液,定容时俯视容量瓶刻度线,导致溶液体积偏小,浓度偏高;
故答案为:偏高;
③定容摇匀后液面下降低于刻度线,部分液体沾到瓶壁上或者瓶塞上,属于正常操作,溶液浓度不受影响;
故答案为:无影响.
点评 本题考查了配制一定物质的量浓度的溶液的方法,明确配制过程是解题关键,注意误差分析的方法和技巧,侧重对学生能力的培养和解题方法的指导和训练,题目难度不大.

练习册系列答案
相关题目
6.下列各离子中,在溶液里能大量共存的是( )
| A. | K+、Ca2+、Cl-、CO${\;}_{3}^{2-}$ | B. | Na+、I-、Cl-、OH- | ||
| C. | NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、K+、OH- | D. | Na+、Al3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ |
1.某化学兴趣小组设计如下实验方案.将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
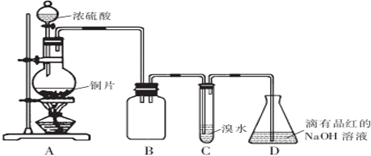
请回答下列问题:
(1)装置B的作用是防倒吸
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应Ⅱ.NaClO不足Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成
下表:(已知酸性:H2SO3>H2CO3>HCl0)

请回答下列问题:
(1)装置B的作用是防倒吸
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应Ⅱ.NaClO不足Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成
下表:(已知酸性:H2SO3>H2CO3>HCl0)
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液呈紫色 | Ⅰ或者Ⅲ |
18.下列离子方程式书写正确的是( )
| A. | CH3COOH与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 金属钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| D. | 氢氧化钠溶液吸收过量的二氧化碳:2OH-+CO2=CO32-+H2O |
5.镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉时,使镁蒸气在某气体中冷却.下列可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2.
①空气 ②CO2 ③Ar ④H2 ⑤N2.
| A. | ①和② | B. | ②和④ | C. | ③和④ | D. | ④和⑤ |
15.下列分子中,所有原子都满足最外层为8电子结构的是( )
| A. | COCl2 | B. | SiH4 | C. | SF6 | D. | PCl5 |