题目内容
阅读下列短文:不同的卤素之间可以相互结合形成一系列的化合物。这类化合物称为卤素互化物。卤素互化物具有很高的化学活性,它们有许多化学性质跟卤素单质相似,例如:能跟大多数金属起反应生成相应的卤化物,也能跟某些非金属单质起反应生成相应的卤化物。溴化碘(IBr)是卤素互化物的一种。这种化合物在常温下是深红色的固体,熔点为41℃,沸点为116℃。下列对IBr的各种描述中,不正确的是
A.在很多化学反应中,溴化碘是一种氧化剂
B.固体溴化碘是一种原子晶体
C.与水能反应:IBr + H2O=HBr+ HIO
D.在Fe3+的催化下可与苯反应生成 和HBr
和HBr
B
【解析】
试题分析:A、溴化碘的性质类似于卤素单质,因此常作氧化剂,A正确;B、溴化碘是一种分子晶体,B错误;C、根据氯气与水的反应可知溴化碘与水反应的方程式可表示为IBr + H2O=HBr+ HIO,C正确;D、溴元素的非金属性强于碘,则与苯发生取代反应生成碘苯和溴化氢,D正确,答案选B。
考点:考查卤素互化物的判断

(11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
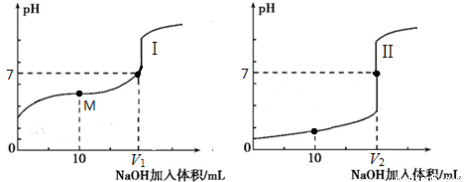
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
(15分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。

其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。

 )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。

 CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是
CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是
 >1
>1 =1
=1



 R—Mg X(格氏试剂);
R—Mg X(格氏试剂);

