题目内容
10.铅蓄电池在放电时的电极反应为正极:PbO2+4H++SO42-+2e-═PbSO4+2H2O;负极:Pb+SO42--2e-═PbSO4,当有20.7g Pb发生反应时,消耗硫酸的物质的量为( )| A. | 0.1 mol | B. | 0.2 mol | C. | 0.05 mol | D. | 0.4 mol |
分析 正极:PbO2+4H++SO42-+2e-═PbSO4+2H2O;负极:Pb+SO42--2e-═PbSO4,则总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,以此来解答.
解答 解:n(Pb)=$\frac{20.7g}{207g/mol}$=0.1mol,由总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O可知,消耗硫酸的物质的量为0.1mol×2=0.2mol,
故选B.
点评 本题考查原电池,为高频考点,把握发生的电池反应、物质的量关系为解答的关键,侧重分析与应用能力的考查,注意物质的量的计算,题目难度不大.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | Cu、Zn、H2SO4形成的原电池装置中,H2主要在Zn电极产生 | |
| B. | 往Fe和稀硫酸反应的装置中,加入少量CuSO4粉末,可加快产生H2的速率 | |
| C. | 2个氢原子变成1个氢气分子的过程中会放出一定的热量,是因为在相同条件下1个氢气分子具有的能量比2个氢原子的能量高 | |
| D. | 化学变化中伴随着化学键的断裂和形成,物理变化中一定没有化学键的断裂和形成 |
3.下列说法正确的一组是( )
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 0.5 mol•L-1的所有一元酸中氢离子浓度都是0.5 mol/L | |
| C. | 强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 |
15.下列表示物质结构的化学用语或模型正确的是( )
| A. | 含17个中子的镁元素的核素符号:${\;}_{17}^{29}$Mg | |
| B. | CH4分子的比例模型: | |
| C. | S2-离子的结构示意图: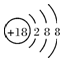 | |
| D. | HF的电子式: |
2.下列说法中不正确的是( )
| A. | 淀粉和纤维素的化学式都是(C6H10O5)n,但由于n不同,淀粉和纤维素并不互为同分异构体 | |
| B. | 鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可用灼烧的方法 | |
| C. | 乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸 | |
| D. | 酯化反应是不可逆的,所以不需要催化剂 |
19.下列说法正确的是( )
| A. | 在一定条件下,乙烷、乙烯、苯均能发生加成反应 | |
| B. |  属于苯的同系物 属于苯的同系物 | |
| C. | 分子式为C5H10O2且能与小苏打溶液反应的有机物(不考虑立体异构)共有4种 | |
| D. | 全降解塑料  ,降解得到的有机物与CH3CH2CH2OH互为同分异构体 ,降解得到的有机物与CH3CH2CH2OH互为同分异构体 |
20.由烃转化为一卤代烃,欲得到较纯的一氯乙烷的方法是 ( )
| A. | 乙烷和氯气发生取代反应 | B. | 乙烯和氯气发生加成反应 | ||
| C. | 乙烯和氯化氢发生加成反应 | D. | 乙炔和氯化氢发生加成反应 |

 +CH3OH+NaCl
+CH3OH+NaCl
 +nCH3OH
+nCH3OH
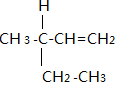
 .
.