题目内容
在一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq),向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度.下列叙述正确的是( )
| A、溶液中钙离子数目减小 |
| B、溶液中钙离子浓度减少 |
| C、溶液中氢氧根离子浓度增大 |
| D、pH减小 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,消耗水,溶液中c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则沉淀溶解平衡向逆反应方向移动,饱和溶液的浓度只与温度有关,溶液浓度保持不变.
解答:
解:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,由于原溶液已经得到饱和,则反应后仍为饱和溶液,溶液各离子浓度不变,则B、C、D错误;
由于反应消耗水,则溶剂质量减少,由于浓度不变,则溶液中Ca2+数减小,故A正确.
故选A.
由于反应消耗水,则溶剂质量减少,由于浓度不变,则溶液中Ca2+数减小,故A正确.
故选A.
点评:本题考查难溶电解质的溶解平衡,侧重于学生的分析能力的考查,注意向悬浊液中加少量生石灰,发生的反应:CaO+H2O=Ca(OH)2,从平衡移动的角度分析,难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
用如图所示装置进行下列实验,能达到实验目的是( )
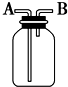

| A、瓶中盛有适量浓H2SO4,从A口进气来干燥NH3 |
| B、从B口进气,用排空气法收集CO2 |
| C、瓶中盛满水,从B口进气,用排水法收集NO2 |
| D、瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
某同学量取50ml 0.5mol/LNaOH溶液和30ml 0.5mol/L H2SO4溶液做中和热实验,测得中和热数据比57.3kJ?mol-1大,其原因可能是( )
| A、实验装置保温、隔热效果差 |
| B、量取NaOH溶液的体积时仰视读数 |
| C、分多次把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D、用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
下列离子方程式书写正确的是( )
| A、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
| B、向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、向Ba(OH)2溶液中加入过量的NaHCO3:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| D、足量Cl2通入1.0mol?L-1 Na2SO3溶液中:2SO32-+Cl2=2S↓+2ClO3- |