题目内容
已知:Cl2+2KI═2KCl+I2(I2常温下为固体,受热易升华)、NH4Cl
NH3+HCl.实验室需要一些纯净的氯化钾,现有的氯化钾中含有少量的KI,K2SO4和NH4Cl,按照下列实验方案提纯氯化钾,并计算不纯氯化钾样品中KI的质量分数.
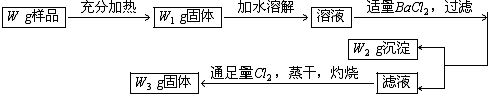
(1)固体加热时反应的方程式为 ;应在 中加热.
(2)能否用Ba(NO3)2代替BaCl2,并说明理由 .
(3)证明SO42-已经沉淀完全的方法是 .
(4)过滤操作使用的仪器为 .
(5)不纯样品中,KI的质量分数(表示式)为 .
| ||

(1)固体加热时反应的方程式为
(2)能否用Ba(NO3)2代替BaCl2,并说明理由
(3)证明SO42-已经沉淀完全的方法是
(4)过滤操作使用的仪器为
(5)不纯样品中,KI的质量分数(表示式)为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:氯化钾中含有少量的KI,K2SO4和NH4Cl,充分加热氯化铵分解生成氨气和氯化氢气体,得到KI,K2SO4,加水溶解得到溶液,加入适量BaCl2,生成硫酸钡沉淀,得到W2g沉淀;滤液为KCl,KI溶液,通入足量氯气蒸干灼烧得到固体W3g为KCl;
(1)固体在试管中加热,氯化铵分解生成氨气和氯化氢;
(2)硝酸钡反应过程中会引入硝酸根离子;
(3)依据硫酸根离子结合钡离子生成白色沉淀设计实验检验,取上层清液加入氯化钡溶液检验;
(4)依据过滤装置选择仪器;
(5)结合沉淀质量依据元素守恒计算KI质量分数;
(1)固体在试管中加热,氯化铵分解生成氨气和氯化氢;
(2)硝酸钡反应过程中会引入硝酸根离子;
(3)依据硫酸根离子结合钡离子生成白色沉淀设计实验检验,取上层清液加入氯化钡溶液检验;
(4)依据过滤装置选择仪器;
(5)结合沉淀质量依据元素守恒计算KI质量分数;
解答:
解:(1)固体在试管中加热,氯化铵分解生成氨气和氯化氢,固体加热时反应的方程式为:NH4Cl
NH3+HCl;
故答案为:NH4Cl
NH3+HCl,试管;
(2)若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,
故答案为:不能,因为用硝酸钡代替氯化钡会引入硝酸钾杂质;
(3)如果所加的氯化钡是少量的,则溶液中含有硫酸根离子,钡离子遇到硫酸根离子会生成白色沉淀,
故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(4)过滤实验所需仪器中有:铁架台、漏斗、玻璃棒、烧杯,
故答案为:铁架台、漏斗、玻璃棒、烧杯;
(5)设原混合物中含硫酸钾质量为X1,反应生成氯化钾质量为X2
K2SO4+BaCl2=BaSO4↓+2KCl
174 233 149
X1 W2 X2
174:233=X1:W2
X1=
233:149=W2:X2
X2=
设原混合物中含KI的质量为X3,反应生成氯化钾质量为X4
2KI+Cl2=2KCl+I2
332 149
X3 X4
332:149=X3:X4
X4=
根据题意可知W1固体中含有氯化钾、硫酸钾、碘化钾;
所以W1固体中含原有氯化钾的质量为W1-X1-X3=W1-
-X3
W3中含含有的氯化钾和生成的氯化钾,因为I2受热时升华,
所以W3中含原有氯化钾的质量为W3-X4=W3-
-
W1-
-X3=W3-
-
X3=332×(W1-
-W3 +
)÷183
不纯氯化钾样品中KI的质量分数=
×100%
答:不纯氯化钾样品中KI的质量分数为
×100%;
| ||
故答案为:NH4Cl
| ||
(2)若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,
故答案为:不能,因为用硝酸钡代替氯化钡会引入硝酸钾杂质;
(3)如果所加的氯化钡是少量的,则溶液中含有硫酸根离子,钡离子遇到硫酸根离子会生成白色沉淀,
故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(4)过滤实验所需仪器中有:铁架台、漏斗、玻璃棒、烧杯,
故答案为:铁架台、漏斗、玻璃棒、烧杯;
(5)设原混合物中含硫酸钾质量为X1,反应生成氯化钾质量为X2
K2SO4+BaCl2=BaSO4↓+2KCl
174 233 149
X1 W2 X2
174:233=X1:W2
X1=
| 174W2 |
| 233 |
233:149=W2:X2
X2=
| 149W2 |
| 233 |
设原混合物中含KI的质量为X3,反应生成氯化钾质量为X4
2KI+Cl2=2KCl+I2
332 149
X3 X4
332:149=X3:X4
X4=
| 149X3 |
| 332 |
根据题意可知W1固体中含有氯化钾、硫酸钾、碘化钾;
所以W1固体中含原有氯化钾的质量为W1-X1-X3=W1-
| 174W2 |
| 233 |
W3中含含有的氯化钾和生成的氯化钾,因为I2受热时升华,
所以W3中含原有氯化钾的质量为W3-X4=W3-
| 149X3 |
| 332 |
| 149W2 |
| 233 |
W1-
| 174W2 |
| 233 |
| 149X3 |
| 332 |
| 149W2 |
| 233 |
X3=332×(W1-
| 174W2 |
| 233 |
| 149W2 |
| 233 |
不纯氯化钾样品中KI的质量分数=
166(w1-
| ||
| 91.5w |
答:不纯氯化钾样品中KI的质量分数为
166(w1-
| ||
| 91.5w |
点评:本题综合考查物质的制备和提纯等知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.注意固体乙中氯化钾既有原混合物中的又有反应生成的部分,为易错点.

练习册系列答案
相关题目
下列电离方程式书写正确的是( )
| A、Ca(OH)2?Ca2++2OH- |
| B、H2SO3?2H++SO32- |
| C、NaHS?Na++HS- |
| D、HCO3-?H++CO32- |
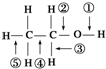 乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )| A、和金属钠反应时键①断裂 |
| B、在铜催化共热下与O2反应时断裂①和③ |
| C、在铜催化共热下与O2反应时断裂①和⑤ |
| D、在空气中完全燃烧时断裂①②③④⑤ |
在氯化铵溶液中,下列关系式正确的是( )
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
将102g由氮气和氢气按1:3的物质的量之比组成的混合气体,在一定条件下通入密闭容器中反应,当N2(g)+3H2(g)?2NH3(g)达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为( )
| A、32.64 g |
| B、65.28 g |
| C、3.84 g |
| D、38.4 g |
将煤处理后变为气体燃料的目的是( )
| A、提高煤的价格 |
| B、提高燃烧效率,减少大气污染 |
| C、方便存放 |
| D、方便运输 |
 (1)如图的装置在实验室中用途比较广泛:
(1)如图的装置在实验室中用途比较广泛: