题目内容
3.下列有关叙述正确的是( )| A. | “氯碱法”的副产品为氢气 | B. | “铝热法”常用于冶炼铁 | ||
| C. | “空气吹出法”用于海水中提取碘 | D. | “侯氏制碱法”制得的是火碱 |
分析 A、氯碱工业是电解氯化钠溶液制备烧碱和氯气的工业;
B、铝热反应是金属铝和氧化铁之间的反应,产物是金属铁和氧化铝;
C、溴单质具有挥发性,碘单质易升华;
D、侯氏制碱法制取的是纯碱碳酸钠.
解答 解:A、氯碱工业是电解氯化钠溶液制备烧碱和氯气的工业,产物中还有氢气,所以“氯碱法”的副产品为氢气,故A正确;
B、铝热反应是金属铝和氧化铁之间的反应,产物是金属铁和氧化铝,金属铁的冶炼采用还原法,故B错误;
C、溴单质具有挥发性,碘单质易升华,“空气吹出法”用于海水中提取溴,故C错误;
D、侯氏制碱法制取的是纯碱碳酸钠,不是火碱氢氧化钠,故D错误,
故选A.
点评 本题涉及金属的冶炼、纯碱的制备、海水提溴原理等知识,注意基本知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
13.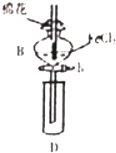 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
14.化学与科学、技术、生产、生活密切相关.下列有关说法中不正确的是( )
| A. | “血液透析”利用了胶体的性质 | |
| B. | 华裔科学家高琨因在光纤传输信息领域中取得突破性成就而获得诺贝尔奖,光纤的主要成分是高纯度的二氧化硅 | |
| C. | 玻璃钢是一种合金,广泛用于汽车车身 | |
| D. | 只要符合限量,“亚硝酸盐”、“食用色素”、“苯甲酸钠”可以作为某些食品的添加剂 |
11.有100mL3mol•L-1的NaOH溶液和100mL1mol•L-1的AlCl3溶液.
(a)将NaOH溶液逐滴滴加到AlCl3溶液中,边滴边振荡,直至滴完;
(b)将AlCl3逐滴滴加到NaOH溶液中,边滴边振荡,直至滴完;
对上述实验所得出的结论正确的是( )
(a)将NaOH溶液逐滴滴加到AlCl3溶液中,边滴边振荡,直至滴完;
(b)将AlCl3逐滴滴加到NaOH溶液中,边滴边振荡,直至滴完;
对上述实验所得出的结论正确的是( )
| A. | 现象相同,沉淀质量相等 | B. | 现象相同,沉淀质量不相等 | ||
| C. | 现象不相同,沉淀质量相等 | D. | 现象不相同,沉淀质量不相等 |
18.下列反应的离子方程式正确的是( )
| A. | 将过量的氯气通入碘化亚铁溶液:3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2 | |
| B. | 硫酸在加热条件下将铜氧化:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 在氢氧化钡溶液中加入过量的硫酸氢铵:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3↑+2H2O | |
| D. | 将金属钠投入水中:2Na+2H+═2Na++H2↑ |
8.下列装置中能构成原电池的是( )
| A. |  酒精 | B. |  稀H2SO4 | C. |  酒精 | D. |  稀H2SO4 |
12.下列说法正确的是(设阿伏加德罗常数的数值为NA)( )
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4L.mol-1 |
