题目内容
【题目】某化学学习小组在学习了Al、Fe的性质后,设计如下实验,探究Cu的常见化合物的性质。
[实验1]探究Cu(OH)2是否具有两性
药品:CuSO4溶液、浓NaOH溶液、稀H2SO4。
实验步骤:
①取少量CuSO4溶液于试管中,逐滴加入浓NaOH溶液至产生较多蓝色沉淀,静置后过滤。
②结论:Cu(OH)2具有两性。
(1)实验步骤②的内容为______
(2)能证明Cu(OH)2具有两性的实验现象为_______
[实验2]探究Cu(I)和Cu(Ⅱ)的稳定性
实验步骤:
①取98gCu(OH)2固体,加热至80~100℃时,得到80g黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。
②冷却后称量,A的质量为72g。
③向A中加人适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)通过计算判断A的化学式为_______(不需要书写计算过程)
(4)步骤③中发生反应的离子方程式为____________
(5)根据上述实验现象得出Cu(I)和Cu(Ⅱ)的稳定性大小的结论为:固态时___________,酸性溶液中________。
[实验3]探究CuO被NH3还原的产物
该学习小组同学设计了如图所示的实验装置(夹持及尾气处理装置未面出)。实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体。

(6)反应产生的无污染气体的化学式为_______
(7)有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计个简单的实验方案验证红色物质中是否含有A:_____。
【答案】 将沉淀分成两份,分别加入稀H2SO4和浓NaOH溶液 Cu(OH)2既能溶于稀H2SO4,又能溶于浓NaOH溶液 Cu2O Cu2O+2H+ == Cu+Cu2++H2O Cu(Ⅰ)比Cu(Ⅱ)稳定 Cu(Ⅱ)比Cu(Ⅰ)稳定 N2 取反应后生成的红色物质少许,加入稀H2SO4,若溶液变为蓝色,说明红色物质中含有A,反之则无
【解析】(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,然后在氢氧化铜中加入硫酸以及氢氧化钠,观察其是否能反应,所以需要的试剂是H2SO4溶液、NaOH溶液, 实验步骤②的内容为将沉淀分成两份,分别加入稀H2SO4和浓NaOH溶液;
因此,本题正确答案是: 将沉淀分成两份,分别加入稀H2SO4和浓NaOH溶液;
(2)能证明Cu(OH)2具有两性的实验现象为Cu(OH)2既能溶于稀H2SO4,又能溶于浓NaOH溶液;
(3)98g Cu(OH)2固体的物质的量为1mol,解热分解生成的72g固体中含有Cu的质量为1mol,即64g,则氧原子的质量为72g-64g=8g, ,
,
则A中n(Cu):n(O)=2:1,所以A的化学式为Cu2O;
(4)向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,说明生成了铜和铜离子,反应的化学方程式为:![]() ,
,
因此,本题正确答案是: Cu2O+2H+ == Cu+Cu2++H2O;
(5)80℃![]() ℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,所以结论为:固态时Cu(Ⅰ)比Cu(Ⅱ)稳定,酸性溶液中Cu(Ⅱ)比Cu(Ⅰ)稳定。
℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,所以结论为:固态时Cu(Ⅰ)比Cu(Ⅱ)稳定,酸性溶液中Cu(Ⅱ)比Cu(Ⅰ)稳定。
(6)氧化铜和氨气反应生成红色物质铜,根据反应遵循质量守恒定律和该气体无污染确定气体为氮气,因此,本题正确答案是:N2;
(7)如含有Cu2O,根据其与酸反应的现象可判断,方程式为: Cu2O+2H+ == Cu+Cu2++H2O,溶液变蓝,而铜与稀硫酸不反应,因此,本题正确答案是: 取反应后生成的红色物质少许,加入稀H2SO4,若溶液变为蓝色,说明红色物质中含有A,反之则无。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】速力菲的主要成分是琥珀酸亚铁,是一种常见的补铁药物。某同学为检测速力菲中Fe2+的存在,设计并进行实验如下:
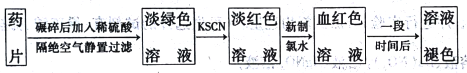
回答下列问题:
(1)实验中碾碎药片需要的仪器是____________。
(2)加KSCN溶液后,溶液呈淡红色,其原因可能是___________。加入新制氯水后,发生反应的离子方程式为_________________。
(3)放置一段时间后,溶液的颜色会逐渐褪去。请对溶液褪色的原因作出2种猜想:
编号 | 猜想 |
甲 | ______ |
乙 | _______ |
(4)医学上服用维生素C,可防止二价亚铁离子被氧化,由此推测维生素C具有______性。
(5)正常人每天应补充14mg左右的铁,其中绝大部分来自于食物。如果全部通过服用含FeS04·7H2O的片剂来补充铁,则正常人每天需服用含_____mgFeSO4·7H2O的片剂。
【题目】填写下列表格
物质 | 分子数 | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
氮气 | _________ | 14 | _________ | 28 |
水 | _________ | _________ | 2 | 18 |
硝酸 | 9.03×1023 | _________ | _________ | 63 |
【题目】实验室里有4个药品橱,已经存放以下列试剂:
药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
药品 | 醋酸,乙醇 | CuSO45H2O,MgCl2 | 白磷,硫黄 | 镁条,锌粒 |
实验室新购进一些碘化钾,应该将这些碘化钾放在( )
A.甲橱
B.乙橱
C.丙橱
D.丁橱