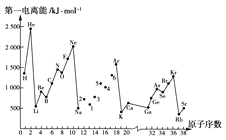
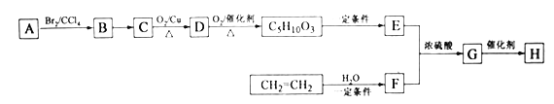
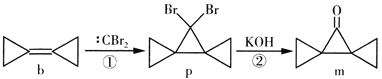
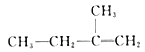题目内容
【题目】(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中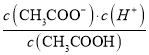 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________(填“酸”、“碱”或“中”,下同)性,NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______________________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为______________________________________________________。
【答案】 逆 不变 中 碱 NH![]() H2A===2H++A2- 3 C c(NH
H2A===2H++A2- 3 C c(NH![]() )>c(A2-)>c(H+)>c(OH-)
)>c(A2-)>c(H+)>c(OH-)
【解析】(1)醋酸溶液存在电离平衡CH3COOH![]() CH3COO-+H+;加入0.1 mol CH3COONa固体,相当于增加了c(CH3COO-),平衡逆反应方向移动;
CH3COO-+H+;加入0.1 mol CH3COONa固体,相当于增加了c(CH3COO-),平衡逆反应方向移动; 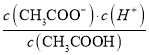 =K,K为电离平衡常数,只与温度有关,温度不变,电离平衡常数不变,正确选项:逆; 不变。
=K,K为电离平衡常数,只与温度有关,温度不变,电离平衡常数不变,正确选项:逆; 不变。
(2)根据题给信息,同一条件下,醋酸和一水合氨的电离平衡常数相等,二者电离程度相等,也就是醋酸铵中铵根离子和醋酸根离子水解程度相等,导致醋酸铵溶液呈中性;醋酸的酸性大于碳酸,则碳酸氢根离子的水解能力大于铵根离子的水解能力,所以NH4HCO3溶液呈碱性;水解能力小的离子在溶液中浓度最大,所以NH4HCO3溶液中物质的量浓度最大的离子是NH![]() ;正确答案:中 、碱、 NH
;正确答案:中 、碱、 NH![]() 。
。
(3)①99 ℃时,Kw=1.0×10-12,该温度下纯水的pH=6,测得0.1 mol·L-1 Na2A溶液的pH=6,说明Na2A是强酸强碱盐,H2A为强酸,水溶液中完全电离,电离方程式为H2A=2H++A2-;正确答案:H2A=2H++A2-。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液中氢离子浓度=0.01×2÷20=0.001 mol·L-1,pH=3;正确答案:3。
③盐酸、H2A均为强酸,溶液中c(H+)=0.1 mol·L-1,两溶液体积相等,所以两种强酸提供的氢离子的总量相等,分别与足量的Zn反应,产生氢气的量就相等;正确选项C。
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,二者恰好完全反应生成(NH4)2A,它为强酸弱碱盐,其溶液呈酸性,所以c(H+)>c(OH-);铵根离子水解能力较弱,所以c(NH![]() )>c(A2-),则离子浓度从大到小的顺序c(NH
)>c(A2-),则离子浓度从大到小的顺序c(NH![]() )>c(A2-)>c(H+)>c(OH-);正确答案:c(NH
)>c(A2-)>c(H+)>c(OH-);正确答案:c(NH![]() )>c(A2-)>c(H+)>c(OH-)。
)>c(A2-)>c(H+)>c(OH-)。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案