题目内容
10.下列方法或操作正确且能达到预期目的是:( )| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ②③⑤ |
分析 ①水和乙醇中的羟基氢活泼性不同;
②CH2=CHCHO中的碳碳双键和醛基都能使高锰酸钾溶液褪色;
③重金属盐可以使蛋白质变性,为不可逆过程;
④检验溴乙烷中的溴元素,可将少量溴乙烷与NaOH溶液混合共热发生水解反应生成溴化钠,再检验溴离子;
⑤不同反应的反应速率大小与反应热数据的大小无关.
解答 解:①水和乙醇中的羟基氢活泼性不同,与钠反应剧烈程度不同,钠和水反应剧烈,和乙醇反应缓慢,可以利用与钠反应判断水和乙醇中羟基氢的活泼性强弱,故正确;
②CH2=CHCHO中的碳碳双键和醛基都能使高锰酸钾溶液褪色;欲证明CH2=CHCHO中含有碳碳双键可先用新制氢氧化铜氧化醛基后再通入高锰酸钾溶液褪色证明,故错误;
③重金属盐可以使蛋白质变性,向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中,沉淀不溶解,可证明蛋白质已变性,故正确;
④检验溴乙烷中的溴元素,可将少量溴乙烷与NaOH溶液混合共热发生水解反应生成溴化钠,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,产生淡黄色沉淀,故正确;
⑤不同反应的反应速率大小与反应热数据的大小无关,故错误,
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验操作与目的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.将碳酸钠和碳酸氢钠的混合物21.0g加热到质量不再变化时,剩余物质的质量为14.8g,求原混合物中碳酸钠的质量分数( )
| A. | 20.0% | B. | 38.7% | C. | 50.0% | D. | 81.3% |
1.在中学化学教材后所附的周期表中,若甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列有关判断中正确的是( )
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其它周期均为18种元素 | |
| C. | 乙元素的族序数比甲元素的族序数小 | |
| D. | 甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙 |
15.下列叙述正确的是( )
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
2.一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质:①石墨粉 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥氯化钠溶液 ⑦硝酸钾溶液 ⑧氯化铜时,能够加快反应速率,又不影响产生H2的总量的是( )
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
19.下列说法错误的是( )
| A. | SiO2是沙子的主要成分,纯净的SiO2是光纤制品的基本原料 | |
| B. | 水晶的基本结构单元是[SiO4]四面体结构 | |
| C. | 将游离态的氮转变为氮的化合物就是氮的固定,合成氨是一种人工固氮方法 | |
| D. | 将等物质的量的氯气和二氧化硫同时通入品红溶液中,褪色比二氧化硫通入品红溶液快 |
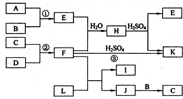 图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.
图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.