题目内容
2.有关原电池的下列说法中正确的是( )| A. | 在外电路中电子由正极流向负极 | |
| B. | 在原电池中负极发生还原反应 | |
| C. | 原电池中正极一定是不活泼金属 | |
| D. | 原电池工作时,阳离子向正极方向移动 |
分析 原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动,据此回答判断.
解答 解:A、原电池中,失电子的电极作负极,电子由负极流向正极,故A错误;
B、原电池中,失电子的电极作负极,负极失去电子发生氧化反应,故B错误;
C、原电池中正极不一定是不活泼金属,如金属镁、铝、氢氧化钠构成的原电池中,金属镁是正极,故C错误;
D,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,会判断电子在外电路的流向及溶液中阴阳离子的移动方向.

练习册系列答案
相关题目
12.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
13.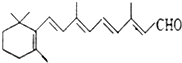 人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )
人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )
 人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )
人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )| A. | 视黄醛的分子式为C20H27O | |
| B. | 视黄醛可以使溴水和酸性高锰酸钾溶液褪色,也能发生银镜反应 | |
| C. | 视黄醛分子结构中含有苯环、碳碳双键和醛基 | |
| D. | 1mol视黄醛在催化剂的作用下最多可与5molH2发生加成反应 |
17.随着卤族元素原子序数递增,下列说法正确的是( )
| A. | 单质的氧化性逐渐减弱 | B. | 单质的熔、沸点逐渐降低 | ||
| C. | 单质的密度逐渐降低 | D. | 气态氢化物的稳定性逐渐增强 |
14.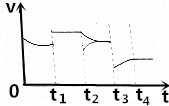 如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
 如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )| A. | t1时改变的条件是增大压强,且平衡没有移动 | |
| B. | t2时改变的条件时减小甲醇的浓度,且平衡正向移动 | |
| C. | t2时改变的条件是增大了氢气的浓度,且平衡正向移动 | |
| D. | t3是改变的条件是升高温度,且平衡正向移动 |
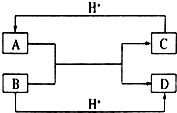 已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):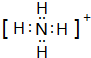 ;D
;D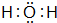 .写出B、C的离子符号或化学式:BOH-;CNH3.
.写出B、C的离子符号或化学式:BOH-;CNH3. ,乙酸官能团的名称羧基.
,乙酸官能团的名称羧基.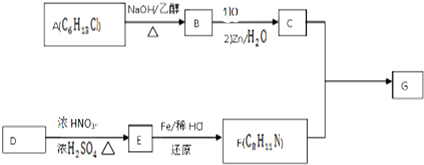
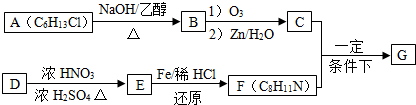
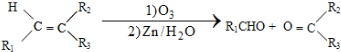
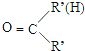 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O.
+H2O. .
. .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$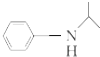
 .
.