题目内容
下列有关叙述正确的是( )
| A、第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
B、S2-的结构示意图: |
| C、元素原子的最外层电子数等于元素的最高化合价 |
| D、多电子原子中,在离核较近的区域内运动的电子能量较低 |
考点:核素,原子结构示意图,原子核外电子的能级分布
专题:原子组成与结构专题
分析:A.同位素的质子数相同;
B.S2-的电子数比原子多2个;
C.O、F无正价;
D.能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动.
B.S2-的电子数比原子多2个;
C.O、F无正价;
D.能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动.
解答:
解:A.同位素的质子数相同,则第IA族元素铯的两种同位素137Cs比133Cs的质子数相同,故A错误;
B.硫离子(S2-)的结构示意图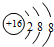 ,故B错误;
,故B错误;
C.最外层电子数不一定等于元素的最高化合价,如O、F无正价,故C错误;
D.多电子原子中,核外电子的能量是不同的,能量低的通常在离核较近的区域运动,能量高的电子在离核远的区域运动,故D正确.
故选D.
B.硫离子(S2-)的结构示意图
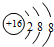 ,故B错误;
,故B错误;C.最外层电子数不一定等于元素的最高化合价,如O、F无正价,故C错误;
D.多电子原子中,核外电子的能量是不同的,能量低的通常在离核较近的区域运动,能量高的电子在离核远的区域运动,故D正确.
故选D.
点评:本题考查同位素、原子结构示意图、原子核外电子排布等知识,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列关于反应热的说法正确的是( )
| A、当△H为“一”时,表示该反应为吸热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 | ||
| D、反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关 |
下列关于气体制备不正确的是( )
| A、铜与稀硫酸反应制取氢气 |
| B、碳酸钙与稀盐酸反应制取二氧化碳 |
| C、过氧化钠与水反应制取氧气 |
| D、氯化铵固体与氢氧化钙固体混合加热制取氨气 |
下列离子方程式中,书写正确的是( )
| A、醋酸与烧碱混合:H++OH-═H2O |
| B、碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O |
| C、稀硫酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
| D、硫酸铜溶液和氢氧化钡溶液混合:Cu2++2OH═Cu(OH) 2↓ |
某有机物质的结构简式为  ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )
 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A、还原 | B、酯化 | C、加成 | D、氧化 |
下列说法正确的是( )
| A、CaCl2 晶体既有离子键又有共价键 |
| B、KOH熔化破坏了离子键和共价键 |
| C、水结成冰体积膨胀,密度变小,因为水分子间存在氢键 |
| D、分子组成和结构相似的分子晶体,一般分子量越大,分子间作用力越强,因此,HF、HCl、HBr、HI沸点依次升高 |
下列气体可用同一装置制取和收集的是( )
| A、H2和SO2 |
| B、H2和C2H2 |
| C、NH3和C2H4 |
| D、Cl2和C2H4 |
下列离子方程式书写正确的是( )
A、碳酸钙与盐酸反应:CO
| ||
B、碳酸钡与硫酸反应:BaCO3+2H++SO
| ||
| C、钠与水反应:Na+H2O═Na++OH-+H2↑ | ||
| D、铜片与硝酸银溶液反应:Cu+Ag+═Cu2++Ag |
下列物质中,含有共价键的化合物是( )
| A、H2 |
| B、Al |
| C、KI |
| D、CO2 |