题目内容
氟是最活泼的非金属,虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功.1986年,化学家Karl Christe首次用化学方法制得了F2.他提出的三步反应如下
①KMnO4+KF+H2O2+HF→K2Mn F6+O2+H2O
②SbCl5+HF→SbF5+HCl
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑
(1)反应①中KMnO4与H2O2的物质的量之比为
(2)反应③中的氧化剂为 ,被氧化的元素为 .
(3)反应③中产生1molKSbF6,则反应中转移电子的物质的量为 mol.若将该步改用惰性电极进行电解,则F2应当在 附近逸出.
(4)反应②恰好反应后,若产生的HCl在标况下为44.8L,将其溶于适量的水后配成浓盐酸,然后与过量的MnO2反应,产生的Cl2与含1molNaOH的溶液在常温下反应,最终出现的情况是
A.Cl2过量 B.NaOH过量 C.恰好反应 D.无法确定.
①KMnO4+KF+H2O2+HF→K2Mn F6+O2+H2O
②SbCl5+HF→SbF5+HCl
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑
(1)反应①中KMnO4与H2O2的物质的量之比为
(2)反应③中的氧化剂为
(3)反应③中产生1molKSbF6,则反应中转移电子的物质的量为
(4)反应②恰好反应后,若产生的HCl在标况下为44.8L,将其溶于适量的水后配成浓盐酸,然后与过量的MnO2反应,产生的Cl2与含1molNaOH的溶液在常温下反应,最终出现的情况是
A.Cl2过量 B.NaOH过量 C.恰好反应 D.无法确定.
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)KMnO4+KF+H2O2+HF→K2MnF6+O2+H2O中,Mn元素的化合价由+7价降低为+4价,H2O2中O元素的化合价由-1价升高为0;
(2)2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑中Mn元素的化合价降低,F元素的化合价升高;
(3)③中产生1molKSbF6,生成0.25molF2,由F元素的化合价变化计算转移电子;F失去电子,发生氧化反应;
(4)HCl在标况下为44.8L,n(HCl)=
=2mol,与过量的MnO2反应,随反应进行稀盐酸不再反应,产生的Cl2小于0.5mol,结合Cl2+2NaOH=NaCl+NaClO+H2O分析.
(2)2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑中Mn元素的化合价降低,F元素的化合价升高;
(3)③中产生1molKSbF6,生成0.25molF2,由F元素的化合价变化计算转移电子;F失去电子,发生氧化反应;
(4)HCl在标况下为44.8L,n(HCl)=
| 44.8L |
| 22.4L/mol |
解答:
解:(1)KMnO4+KF+H2O2+HF→K2MnF6+O2+H2O中,Mn元素的化合价由+7价降低为+4价,H2O2中O元素的化合价由-1价升高为0,由电子守恒可知,KMnO4与H2O2的物质的量之比为
=2:3,故答案为:2:3;
(2)2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑中Mn元素的化合价降低,则氧化剂为K2MnF6,F元素的化合价升高,失去电子被氧化,故答案为:K2MnF6;F;
(3)③中产生1molKSbF6,生成0.25molF2,由F元素的化合价可知转移电子为0.25mol×2×[0-(-1)]=0.5mol;F失去电子,发生氧化反应,则改用惰性电极进行电解,则F2应当在阳极附近逸出,故答案为:0.5;阳极;
(4)HCl在标况下为44.8L,n(HCl)=
=2mol,与过量的MnO2反应,随反应进行稀盐酸不再反应,产生的Cl2小于0.5mol,由Cl2+2NaOH=NaCl+NaClO+H2O可知,1molNaOH完全反应需要0.5molCl2,则NaOH有剩余,故答案为:B.
| (1-0)×2 |
| (7-4) |
(2)2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑中Mn元素的化合价降低,则氧化剂为K2MnF6,F元素的化合价升高,失去电子被氧化,故答案为:K2MnF6;F;
(3)③中产生1molKSbF6,生成0.25molF2,由F元素的化合价可知转移电子为0.25mol×2×[0-(-1)]=0.5mol;F失去电子,发生氧化反应,则改用惰性电极进行电解,则F2应当在阳极附近逸出,故答案为:0.5;阳极;
(4)HCl在标况下为44.8L,n(HCl)=
| 44.8L |
| 22.4L/mol |
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的计算及电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
关于下列各装置图的叙述中,正确的是( )
A、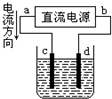 d极发生氧化反应、c极发生还原反应 |
B、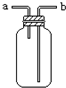 从a口通入气体,可用于收集H2、NH3、NO等气体 |
C、 X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 |
D、 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
下列有关化学与生活、工业的叙述中,正确的是( )
| A、工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 |
| B、硅单质可用于制造光导纤维 |
| C、2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 |
| D、固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
目前利用废弃塑料的基本方法有( )
①加热熔融或粉碎后,直接用做生产新产品的材料;
②加热分裂成小分子物质,小分子物质又可循环再用于制造新的塑料;
③催化裂解可以制得柴油、煤油、汽油及可燃气体.其中涉及化学变化的有.
①加热熔融或粉碎后,直接用做生产新产品的材料;
②加热分裂成小分子物质,小分子物质又可循环再用于制造新的塑料;
③催化裂解可以制得柴油、煤油、汽油及可燃气体.其中涉及化学变化的有.
| A、①和② | B、②和③ |
| C、①和③ | D、只有③ |
下列说法不正确的是( )
①将SO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②配制FeSO4溶液时,要向其中加少量硫酸与铁粉,目的是为了防止Fe2+的水解与氧化
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
⑤使用明矾可以对水进行消毒、杀菌.
①将SO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②配制FeSO4溶液时,要向其中加少量硫酸与铁粉,目的是为了防止Fe2+的水解与氧化
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
⑤使用明矾可以对水进行消毒、杀菌.
| A、只有② | B、①②③⑤ |
| C、①②③④ | D、①③④⑤ |
向明矾溶液中逐渐滴加Ba(OH)2溶液,符合要求的离子方程式为( )
| A、加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓ |
| B、溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C、SO42-离子恰好完全沉淀时:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-→Al(OH)3↓+BaSO4↓ |
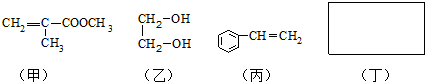
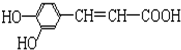
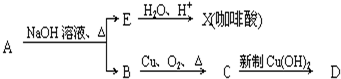
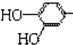 结构;②能发生水解反应;R的结构简式为
结构;②能发生水解反应;R的结构简式为 (1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol
(1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol