题目内容
下列叙述正确的是( )
| A、常温下,无论是纯水,还是酸、碱、盐的稀溶液中,c(H+)?c(OH-)=1×10-14 |
| B、c(H+)=1×10-7 mol?L-1的溶液一定是中性溶液 |
| C、0.2 mol?L-1 醋酸溶液中的c(H+)是0.1 mol?L-1 醋酸溶液中的c(H+)的2倍 |
| D、任何浓度的溶液都可以用pH来表示其酸碱性的强弱 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A、Kw只有温度有关;
B、溶液呈酸碱性的实质是溶液中氢离子浓度与氢氧根离子浓度的相对大小;
C、弱酸在溶液中存在电离平衡;
D、在稀溶液中用pH来表示其酸碱性的强弱.
B、溶液呈酸碱性的实质是溶液中氢离子浓度与氢氧根离子浓度的相对大小;
C、弱酸在溶液中存在电离平衡;
D、在稀溶液中用pH来表示其酸碱性的强弱.
解答:
解:A、Kw只有温度有关,温度不变Kw不变,所以常温下,无论是纯水,还是酸、碱、盐的稀溶液中,c(H+)?c(OH-)=1×10-14,故A正确;
B、溶液呈酸碱性的实质是溶液中氢离子浓度与氢氧根离子浓度的相对大小,c(H+)=1×10-7 mol?L-1的溶液不一定是中性溶液,若温度高于常温,则为碱性,故B错误;
C、弱酸在溶液中存在电离平衡,浓度越大电离程度越大,所以0.2 mol?L-1 醋酸溶液中的c(H+)小于0.1 mol?L-1 醋酸溶液中的c(H+)的2倍,故C错误;
D、在稀溶液中用pH来表示其酸碱性的强弱,当浓度大于1mol/L时,一般不用PH表示其酸碱性的强弱,故D错误;
故选A.
B、溶液呈酸碱性的实质是溶液中氢离子浓度与氢氧根离子浓度的相对大小,c(H+)=1×10-7 mol?L-1的溶液不一定是中性溶液,若温度高于常温,则为碱性,故B错误;
C、弱酸在溶液中存在电离平衡,浓度越大电离程度越大,所以0.2 mol?L-1 醋酸溶液中的c(H+)小于0.1 mol?L-1 醋酸溶液中的c(H+)的2倍,故C错误;
D、在稀溶液中用pH来表示其酸碱性的强弱,当浓度大于1mol/L时,一般不用PH表示其酸碱性的强弱,故D错误;
故选A.
点评:本题考查了Kw的影响因素、溶液酸碱性的判断、弱电解质的电离等,侧重于基础知识应用的考查,题目难度不大.

练习册系列答案
相关题目
将KClO3、I2各0.02mol加入12g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发).将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气.则A的化学式可能是( )
| A、I2Cl6 |
| B、HClO |
| C、IClO |
| D、KIO3 |
 X、Y、Z、W均为短周期元素,原子序数依次增大,其中X、Y、Z在周期表中的相对位置如图所示.Y是短周期主族元素中原子半径最大的元素,W的最高正化合价与最低负化合价的代数和为0,下列说法中不正确的是( )
X、Y、Z、W均为短周期元素,原子序数依次增大,其中X、Y、Z在周期表中的相对位置如图所示.Y是短周期主族元素中原子半径最大的元素,W的最高正化合价与最低负化合价的代数和为0,下列说法中不正确的是( )| A、W的氧化物可以用于制造太阳能电池 |
| B、最高价氧化物对应水化物的碱性Y比X强 |
| C、可以用电解法制备Z单质 |
| D、Y和Z的最高价氧化物对应水化物之间可以相互反应 |
下列判断中一定正确的是( )
| A、若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y |
| B、若X、Y属于同主族元素,且相对原子质量:X>Y,则X的失电子能力比Y强 |
| C、若R2-和M+的电子层结构相同,则原子序数:R>M |
| D、若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
下列表述与示意图相符的是( )
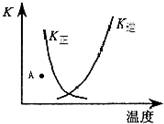

| A、正反应为吸热反应 | ||
| B、升高温度,有利于反应向正方向进行 | ||
| C、A点时,反应向逆反应方向移动 | ||
D、K正与K逆的关系是:K正=
|
物质变化过程中常常伴随着能量的变化.下列过程中一定向外释放能量的是( )
| A、石油裂化 |
| B、氢气与碘蒸气化合 |
| C、铵盐溶于水 |
| D、形成碳氢键 |