题目内容
 已知:xA(g)+yB(g)?zC(g);△H=a.将x molA和y molB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)
已知:xA(g)+yB(g)?zC(g);△H=a.将x molA和y molB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示.下列判断正确的是( )
| A、x+y=z;a>0 |
| B、x+y>z;a<0 |
| C、x+y<z;a<0 |
| D、x+y<z;a>0 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:根据影响化学反应速率和化学平衡的因素进行判断得出正确结论.升高温度,化学反应速率加快,平衡向着吸热的方向移动;增大压强,化学反应速率加快,平衡向着气体体积减小的方向移动.
解答:
解:P2时,T1>T2,升高温度,C的物质的量减小,平衡逆向移动,则正反应为放热反应,故a<0;
T2时,P1>P2,增大压强,C的物质的量增大,说明平衡正向移动,故x+y>z,
故选B.
T2时,P1>P2,增大压强,C的物质的量增大,说明平衡正向移动,故x+y>z,
故选B.
点评:本题考查温度、压强对化学平衡的影响,难度中等.根据温度、压强与生成物C物质的量的变化确定反应热及气体的计量数变化.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
X、Y、Z、W都是短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Z同主族,Y、Z同周期,W与X、Y既不同族也不同周期;X、Y、Z三种原子的最外层电子数之和为19.下列说法正确的是( )
| A、Y元素最高价氧化物对应水化物的化学式为:HYO4 |
| B、X、Y、Z形成的简单离子的半径大小为:Yn->Zm->Xm- |
| C、元素Z、Y分别与元素W形成的化合物的热稳定性为:WmZ>WnY |
| D、相同条件下,HnY溶液的酸性比HmZ溶液的酸性弱 |
 维生素C(vitaminC)又名L-抗坏血酸,具有有酸性和强还原性,也是一种常见的食品添加剂,其结构如图所示,下列有关说法正确的是( )
维生素C(vitaminC)又名L-抗坏血酸,具有有酸性和强还原性,也是一种常见的食品添加剂,其结构如图所示,下列有关说法正确的是( )| A、维生素C的分子式为C6H10O6 |
| B、维生素C由于含有酯基而难溶于水 |
| C、维生素C由于含有C=O键而能发生银镜反应 |
| D、维生素C的酸性可能是由五元环上的两个羟基引起的 |
将20mL0.5mol.L-1KOH溶液加水稀释到500mL,稀释后溶液中KOH的物质的量浓度为( )
| A、0.2mol.L-1 |
| B、0.02mol.L-1 |
| C、0.05mol.L-1 |
| D、0.04mol.L-1 |
实验是化学学习的基础.下列实验叙述正确的是( )
 |  |  | 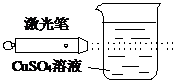 |
| ① | ② | ③ | ④ |
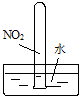
| A、实验①试管最终会充满水 |
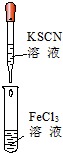
| B、实验②试管中溶液变为血红色 |
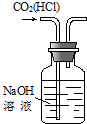
| C、可用实验③装置除去CO2气体中含有的少量HCl杂质 |
| D、实验④CuSO4溶液中会形成一条光亮的通路 |
实验室用锌粒与2mol?L-1硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
| A、向该硫酸溶液中加入少量浓硫酸 |
| B、向该硫酸溶液中加入少量水 |
| C、改用热的2 mol?L-1硫酸溶液 |
| D、用锌粉代替锌粒 |
常温下,下列各溶液的叙述中正确的是( )
| A、NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) |
| B、0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) |
| C、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D、向1.00 L 0.3 mol/LNaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |



