题目内容
在某容积一定的密闭容器中,有下列可逆反应:2A(g)+B(g)=xC(g),反应曲线(T表示温度,P表示压强,C%表示C的体积分数)如图所示,则下列说法正确的是( )


| A、x=2 |
| B、该反应是吸热反应 |
| C、P3>P4,y轴表示B的转化率 |
| D、P3<P4,y轴表示混合气体的密度. |
考点:体积百分含量随温度、压强变化曲线
专题:
分析:由图1可知,温度都为T1,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量增大,说明增大压强平衡向正反应方向移动;压强都为P2,温度T1先到达平衡,故温度T1>T2,温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,据此分析解答;由图Ⅱ,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,结合压强对平衡移动的影响判断P3、P4的关系.
解答:
解:A.由图可知,温度都为T1,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量增大,说明增大压强平衡向正反应方向移动,正反应是一个气体体积减小的反应,则有1+2>x,x等于1或2均可,故A错误;
B.温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,故B错误;
C.由图(Ⅱ)知:因随着温度升高y降低,故y降低的方向必为压强减小的方向,所以,P3>P4,随着温度的升高,平衡将向左移动,B的转化率降低,故C正确;
D.容器的体积不变,气体的质量不变,故气体密度不变,故D错误,
故选C.
B.温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,故B错误;
C.由图(Ⅱ)知:因随着温度升高y降低,故y降低的方向必为压强减小的方向,所以,P3>P4,随着温度的升高,平衡将向左移动,B的转化率降低,故C正确;
D.容器的体积不变,气体的质量不变,故气体密度不变,故D错误,
故选C.
点评:本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义.由于勒夏特列原理只适用于“单因素”(浓度或温度或压强)改变,分析时应固定一个物理量,分析另一物理量对纵坐标的影响.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
下列说法正确的是( )
| A、室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B、醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
| C、相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| D、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3?H2O)=1.8×10-5,下列叙述中不正确的是( )
| A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B、25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C、25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
| D、25℃时,NH4++H2O?NH3?H2O+H+的平衡常数为5.6×10-10 |
关于下列各装置图的叙述中,正确的是( )
A、 验证化学能转化为电能 |
B、 比较硫、碳、硅三种元素的非金属行强弱 |
C、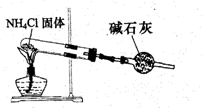 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |


 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: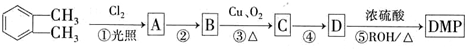
 的名称
的名称 制备DMP的另一种途径:
制备DMP的另一种途径:

 某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.