题目内容
12.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )| A. | 氧化物对应的水化物的酸性:b<c | |
| B. | 元素的非金属性次序为:c>b>a | |
| C. | d与其他3种元素均能形成离子化合物 | |
| D. | 含d元素的化合物的焰色反应呈紫色 |
分析 原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1,a-的电子层结构与氦相同,则a为H元素;b和c的次外层有8个电子,二者都含有3个电子层,则b为S元素,c为Cl元素;c-和d+的电子层结构相同,则d为K元素,据此结合元素化合物的性质及元素周期律解答.
解答 解:原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1,a-的电子层结构与氦相同,则a为H元素;b和c的次外层有8个电子,则b为S元素,c为Cl元素;c-和d+的电子层结构相同,则d为K元素,
A.b为S元素,c为Cl元素,最高价氧化物对应水合物的酸性:B<c,没有指出最高价,无法判断二者含氧酸的酸性强弱,故A错误;
B.同周期自左而右非金属性增强,氢化物中H元素为正价,其非金属性最弱,故非金属性Cl>S>H,故B正确;
C.d为K,a为H、为S元素、c为Cl元素,K元素能够与H、S、Cl分别形成离子化合物KH、K2S、KCl,故C正确;
D.d为K元素,K元素的焰色反应呈紫色,故D正确;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,推断元素是解题关键,侧重对元素周期律的考查,题目涉及金属氢化物是中学知识的盲点,题目难度不大.

练习册系列答案
相关题目
3.双酚A(也称BPA)常用作塑料制品添加剂,其结构简式如图所示.下列关于双酚A的叙述正确的是( )
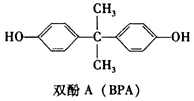

| A. | 双酚A分子的核磁共振谱有4组峰 | |
| B. | 双酚A分子中所有的碳原子可能共平面 | |
| C. | 1mol双酚A最多可与2molBr2反应 | |
| D. | 双酚A与足量H2反应的产物属于芳香醇 |
7.有关有机物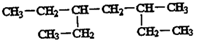 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )
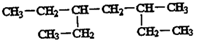 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )| A. | 该有机物属于烷烃 | |
| B. | 该有机物与3-甲基-5-乙基辛烷互为同系物 | |
| C. | 该有机物与2,5-二甲基一3-乙基己烷互为同分异构体 | |
| D. | 该有机物命名时,主链上的碳原子数为6 |
17.甲酸乙酯为允许使用的食用香料,又称蚁酸乙酯,有辛辣的刺激味和菠萝样的果香香气,还有强烈朗姆酒似香气,并略带苦味.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点如表

(1)制备粗品
将4mL乙醇、3mL甲酸和2mL浓硫酸加入试管a中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管b内得到甲酸乙酯的粗品.
①实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓硫酸用量又不能过多,原因是浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率.
②球形干燥管C的作用是防止倒吸、冷凝.
③若用乙装置制备甲酸乙酯,其缺点有受热不均匀,不易于控制温度;原料损失较大、易发生副反应.
(2)制备精品
①反应结束后,从试管b中分离出甲酸乙酯粗品所用的主要仪器分液漏斗.
②从b中分离出的甲酸乙酯中常含有少量的乙醇、乙醚和水,应先加入无水氯化钙,除去乙醇和水,然后再通过蒸馏操作得到甲酸乙酯.
③某同学用装有饱和氢氧化钠的试管收集甲酸乙酯,几乎没有收集到产物.原因是HCOOCH2CH3+NaOH→HCOONa+CH3CH2OH(用化学方程式解释).
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点如表
| 试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |

(1)制备粗品
将4mL乙醇、3mL甲酸和2mL浓硫酸加入试管a中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管b内得到甲酸乙酯的粗品.
①实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓硫酸用量又不能过多,原因是浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率.
②球形干燥管C的作用是防止倒吸、冷凝.
③若用乙装置制备甲酸乙酯,其缺点有受热不均匀,不易于控制温度;原料损失较大、易发生副反应.
(2)制备精品
①反应结束后,从试管b中分离出甲酸乙酯粗品所用的主要仪器分液漏斗.
②从b中分离出的甲酸乙酯中常含有少量的乙醇、乙醚和水,应先加入无水氯化钙,除去乙醇和水,然后再通过蒸馏操作得到甲酸乙酯.
③某同学用装有饱和氢氧化钠的试管收集甲酸乙酯,几乎没有收集到产物.原因是HCOOCH2CH3+NaOH→HCOONa+CH3CH2OH(用化学方程式解释).
4.莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
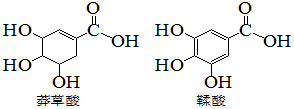

| A. | 莽草酸分子式为C7H10O5 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子互为同系物 | |
| D. | 等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的物质的量相同 |
12.某二元酸(H2A)在水中的电离方程式为H2A═H++HA-,HA-?H++A2-(25℃时Ka=1.0×10-2),下列说法正确的是( )
| A. | 在0.1mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5mol•L-1 | |
| B. | 在0.1mol•L-1的H2A溶液中,c(H+)>0.12mol•L-1 | |
| C. | 将同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,混合溶液可能呈碱性 | |
| D. | 0.1mol•L-1的NaHA溶液中离子浓度为c(Na+)>c(H+)>c(A2-)>c(OH-) |
13.下列化学用语表示正确的是( )
| A. | 硫原子的结构示意图: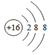 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为7 的碳原子:${\;}_{6}^{7}$C | D. | CO2 的电子式: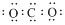 |