题目内容
9.下列物质不能通过化合反应制得的是( )| A. | FeCl2 | B. | NaHCO3 | C. | Al(OH)3 | D. | Fe(OH)3 |
分析 A.可由氯化铁和铁发生化合反应生成;
B.碳酸钠、水以及二氧化碳反应会生成碳酸氢钠;
C.不能由化合反应生成;
D.可由氢氧化亚铁、氧气和水反应生成.
解答 解:A.铁和氯化铁发生化合反应生成氯化亚铁,反应为Fe+2FeCl3=3FeCl2,故A不选;
B.碳酸钠、水以及二氧化碳反应会生成碳酸氢钠,即能通过化合反应制得,故B不选;
C.氧化铝和水不反应,则氢氧化铝不能由化合反应生成,故C选;
D.氢氧化亚铁和氧气水反应化合为氢氧化铁,反应的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故D不选.
故选C.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
19.常温下,下列物质与水混合后静置,出现分层的是( )
| A. | 甲苯 | B. | 甲醇 | C. | 甲醛 | D. | 三氧化硫 |
17.下列物质中,属于离子化合物的是( )
| A. | CO2 | B. | HCl | C. | NaCl | D. | N2 |
4.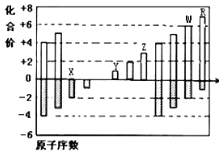 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )| A. | 原子半径:W>Z>Y | |
| B. | 气态氢化物的稳定性:H2X<H2W | |
| C. | Y2X和水反应能生成离子化合物 | |
| D. | Y和Z两者氧化物对应的水化物不能相互反应 |
14.设阿伏加德罗常数的数值为N A,下列说法不正确的是( )
| A. | 加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA | |
| B. | 0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA | |
| C. | 1.6 g CH4中含有的C-H键数目为0.4 NA | |
| D. | 标准状况下,2.24 L H37Cl含有的中子数为2.0 NA |
1.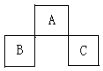 A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
 A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )| A. | Be、Na、Al | B. | O、P、Cl | C. | P、O、Cl | D. | C、Al、P |
11.关于氯气的叙述正确的是( )
| A. | 通常情况下氯气呈黄绿色,有刺激性气味,极易溶于水 | |
| B. | 氯气能够杀菌,常用于居室消毒 | |
| C. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| D. | 把集气瓶小心地放在鼻孔下直接闻氯气的气味 |
12.有关蔗糖与浓硫酸的反应,下列说法错误的有( )
| A. | 浓硫酸表现出酸性 | B. | 浓硫酸表现出脱水性 | ||
| C. | 浓硫酸表现出吸水性 | D. | 浓硫酸表现出强氧化性 |