题目内容
14.设阿伏加德罗常数的数值为N A,下列说法不正确的是( )| A. | 加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA | |
| B. | 0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA | |
| C. | 1.6 g CH4中含有的C-H键数目为0.4 NA | |
| D. | 标准状况下,2.24 L H37Cl含有的中子数为2.0 NA |
分析 A.铜与浓硫酸反应,与稀硫酸不反应;
B.CaO2中阴离子为过氧根离子;
C.1个甲烷分子中含有4个C-H键;
D.气体体积转换为物质的量,1个H37Cl含有20个中子.
解答 解:A.加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,随着反应进行,硫酸浓度降低,所以0.2mol硫酸不能完全反应,转移电子数目小于0.2 NA,故A错误;
B.CaO2中阴离子为过氧根离子,0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA,故B正确;
C、1.6g甲烷的物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,含有的C-H键数目为0.4 NA,故C正确;
D.标准状况下,2.24 L H37Cl物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,含有的中子数为2.0 NA,故D正确;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意浓硫酸与铜反应的条件,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
4.下列气体有颜色的是( )
| A. | C2H4 | B. | Cl2 | C. | NH3 | D. | NO |
5.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
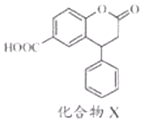

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 1mol化合物X最多可与8molH2发生加成反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
2.下列过程有化学键被破坏同时又有化学键形成的是( )
| A. | 碘升华 | B. | 氯气溶于水 | C. | 氯化钠晶体熔融 | D. | NH4Cl |
9.下列物质不能通过化合反应制得的是( )
| A. | FeCl2 | B. | NaHCO3 | C. | Al(OH)3 | D. | Fe(OH)3 |
17.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | B. | 价电子数:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 第一电离能:Na<Mg<Al |
 运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图.
运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图.


