题目内容
13.在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为ρ g•cm-1.该盐酸物质的量浓度、溶质的质量分数分别为( )| A. | e=$\frac{1}{11.2}$mol•L-1、ω=$\frac{36.5}{224ρ}$% | B. | e=$\frac{1}{22.4}$mol•L-1、ω=$\frac{36.5}{224ρ}$% | ||
| C. | e=$\frac{1}{22.4}$mol•L-1、ω=$\frac{36.5}{112ρ}$% | D. | e=$\frac{1}{11.2}$mol•L-1、ω=$\frac{23}{224}$% |
分析 要求盐酸的物质的量浓度,依据c=$\frac{n}{V}$可知需要计算氯化氢的物质的量和溶液的体积,依据n=$\frac{V}{Vm}$计算氯化氢的物质的量,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽时,水充满烧瓶,说明溶液体积为烧瓶的体积;
依据$\frac{溶质的质量}{溶液的质量}$×100%,计算溶液的质量分数;
解答 解:设烧瓶的体积为1L,则氯化氢的物质的量为$\frac{1}{22.4}$mol,盐酸体积为1L,盐酸的物质的量浓度C=$\frac{1}{\frac{22.4}{1}}$(mol/L)=$\frac{1}{22.4}$mol/L;
溶液质量分数ω=$\frac{\frac{36.5}{22.4}}{1000ρ}$×100%=$\frac{36.5}{224ρ}$%;
故选:B.
点评 本题考查了溶液的物质的量浓度、质量百分数浓度的计算,明确物质的量浓度概念、质量百分数浓度计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
3.关于现行的元素周期表的说法正确的是( )
| A. | 元素周期表有8个副族 | B. | 元素周期表有7个周期 | ||
| C. | 短周期是指第一、二周期 | D. | IA族的元素全部是金属元素 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
1.将足量的两份铝,分别加入到等物质的量的盐酸和氢氧化钠溶液中,放出气体的物质的量之比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 1:3 |
5.下列各组纯净物中,其分子内部都存在极性键且均为共价化合物的是( )
| A. | H2、NH3、SO3 | B. | CO2、CH4、C2H5OH | C. | NO、CaO、Ne | D. | P4、CS2、Na2CO3 |
12.普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )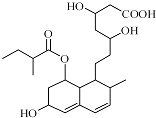

| A. | 该分子中有三种官能团 | B. | 能与FeCl3溶液发生显色反应 | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
13.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )


| A. | 丹参素的分子式为C9H9O5 | |
| B. | 丹参素能发生缩聚、消去、氧化反应 | |
| C. | 1 mol丹参素最多可以和4 mol H2发生加成反应 | |
| D. | 丹参素分子中含有手性碳原子 |
 .
.