题目内容
将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余.试计算(要求有计算过程):
(1)生成的SO2的体积(标准状况下).
(2)若用4mol?L-1的NaOH溶液吸收生成的SO2,恰好生成Na2SO3,计算需要NaOH溶液的体积.
(1)生成的SO2的体积(标准状况下).
(2)若用4mol?L-1的NaOH溶液吸收生成的SO2,恰好生成Na2SO3,计算需要NaOH溶液的体积.
考点:化学方程式的有关计算
专题:计算题
分析:铜和浓硫酸的反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
(1)根据Cu和SO2之间的关系式计算;
(2)SO2和NaOH的反应方程式为:2NaOH+SO2=Na2SO3+H2O,根据氢氧化钠和二氧化硫之间的关系式计算.
| ||
(1)根据Cu和SO2之间的关系式计算;
(2)SO2和NaOH的反应方程式为:2NaOH+SO2=Na2SO3+H2O,根据氢氧化钠和二氧化硫之间的关系式计算.
解答:
解:(1)设生成二氧化硫的体积为x,
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
64g 22.4L
6.4g x
64g:22.4L=6.4g:x
x=
=2.24L,
答:生成的SO2的体积(标准状况下)为2.24 L;
(2)设氢氧化钠的体积为VL,
2NaOH+SO2=Na2SO3+H2O
2mol 22.4L
4Vmol 2.24L
2mol:22.4L=4Vmol:2.24L
V=
=0.05,
答:需要NaOH溶液的体积为0.05 L或50 mL.
Cu+2H2SO4(浓)
| ||
64g 22.4L
6.4g x
64g:22.4L=6.4g:x
x=
| 6.4g×22.4L |
| 64g |
答:生成的SO2的体积(标准状况下)为2.24 L;
(2)设氢氧化钠的体积为VL,
2NaOH+SO2=Na2SO3+H2O
2mol 22.4L
4Vmol 2.24L
2mol:22.4L=4Vmol:2.24L
V=
| 2mol×2.24L |
| 4mol×22.4L |
答:需要NaOH溶液的体积为0.05 L或50 mL.
点评:本题考查了根据方程式进行计算,正确书写方程式是解本题关键,根据方程式中各个物理量之间的关系式解答,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A、22.4L氨气中含氢原子数目为3NA |
| B、5.6g铁与足量稀硫酸反应转移的电子数为0.3NA |
| C、标准状况下,4.48L的氧气和氨气的混合物含有的分子数目为0.2NA |
| D、80g苛性钠溶于1L水中,所得溶液的物质的量浓度为2mol/L |
在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等.请问这些数值准确的说法应该是( )
| A、某种核素的相对原子质量 |
| B、某种核素的近似相对原子质量 |
| C、某种元素的平均相对原子质量 |
| D、某种元素的平均相对原子质量的近似值 |
对实验Ⅰ~Ⅳ的实验现象判断正确的是( )
A、 实验Ⅰ:产生红褐色沉淀 |
B、 实验Ⅱ:试管中溶液变红色 |
C、 实验Ⅲ:试管中溶液变红色 实验Ⅲ:试管中溶液变红色 |
D、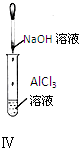 实验Ⅳ:试管中先出现白色沉淀,后溶解 |
 铜、铁、钒都是日常生活中常见的金属,具有广泛用途.
铜、铁、钒都是日常生活中常见的金属,具有广泛用途.

 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.