题目内容
在K2Cr2 O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂, 元素被氧化,还原产物是 ,K2Cr2O7所表现的性质是 ,在方程上用双线桥法标出电子转移的方向和数目 .若转移3mol电子,则所产生的氯气在标准状况下的体积为 .
考点:氧化还原反应
专题:离子反应专题
分析:反应中Cr元素化合价降低,被还原,K2Cr2O7具有氧化性,Cl元素化合价升高,被氧化,HCl具有还原性,氧化还原反应中氧化剂和还原剂之间得失电子的数目相等,表现为化合价升降总数相等,以此解答该题.
解答:
解:反应中Cr元素化合价降低,被还原,K2Cr2O7具有氧化性,为氧化剂,被还原生成CrCl3,Cl元素化合价升高,被氧化,HCl具有还原性,反应中Cr元素化合价由+6价降低为+3价,Cl元素化合价由-1价升高为0价,转移电子数目总共为6,用双线桥表示电子转移情况是: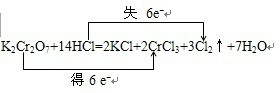 ,由方程式可知,若转移3mol电子,则产生1.5mol氯气,标况下体积为1.5mol×22.4L/mol=33.6L,
,由方程式可知,若转移3mol电子,则产生1.5mol氯气,标况下体积为1.5mol×22.4L/mol=33.6L,
故答案为:K2Cr2O7;Cl;CrCl3;氧化性; ;33.6L.
;33.6L.
 ,由方程式可知,若转移3mol电子,则产生1.5mol氯气,标况下体积为1.5mol×22.4L/mol=33.6L,
,由方程式可知,若转移3mol电子,则产生1.5mol氯气,标况下体积为1.5mol×22.4L/mol=33.6L,故答案为:K2Cr2O7;Cl;CrCl3;氧化性;
 ;33.6L.
;33.6L.
点评:本题考查氧化还原反应知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意从元素化合价的角度判断氧化还原反应的相关概念,注意能熟练用双线桥法标出电子转移的方向和数目.

练习册系列答案
相关题目
对于淀粉和纤维素两种物质,下列说法正确的是( )
| A、二者都能水解,水解的最终产物不同 |
| B、二者C、H、O三种元素的质量分数相同,且互为同分异构体 |
| C、它们都是糖类,且都是高分子化合物 |
| D、都可用(C6H10O5)n表示,但淀粉能发生银镜反应,而纤维素不能 |
现在探索、开发的新能源有( )
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气⑦水煤气 ⑧天然气.
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气⑦水煤气 ⑧天然气.
| A、①④⑤ | B、②③⑥⑦ |
| C、③⑥⑦⑧ | D、①②④ |
好的消毒剂不但消毒效率要高(消毒效率可用单位质量消毒剂还原时的得电子数表示),还要安全.世界卫生组织将C1O2列为A级高效、安全灭菌消毒剂,建议用它取代C12消毒剂.下列说法中错误的是( )
| A、C1O2是强氧化剂 |
| B、C1O2不会把水中的有机物变成有害健康的氯代烃 |
| C、等质量的C1O2对自来水的消毒效率是C12的2.63倍 |
| D、消毒时C1O2被氧化成C12 |
下列关于粒子结构的描述不正确的是( )
| A、H2S和NH3均是价电子总数为8的极性分子 |
| B、HS-和HCl均是含一个极性键的18电子粒子 |
| C、1molD216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) |
| D、CH2C12和CCl4均是四面体构型的非极性分子 |
同种元素形成的不同原子(或离子)一定具有相同的( )
| A、质量数 | B、质子数 |
| C、中子数 | D、核外电子数 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol乙基中含有的电子数为17NA |
| B、标准状况下,22.4L三氯甲烷中共价键数目为4NA |
| C、1mol硫粉与足量的Cu粉共热,转移的电子数为1NA |
| D、7.8gNa2O2晶体中含有阴阳离子总数为0.4NA |
 将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示:
将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示: