题目内容
臭氧可使湿润的淀粉KI试纸变蓝,化学方程式为2KI+O3+H2O═2KOH+I2+O2.下列叙述中正确的是( )
| A、在反应中水被氧化成氧气 |
| B、该反应中水是氧化剂 |
| C、每生成1mol I2,转移的电子数为1mol |
| D、反应中氧化剂与还原剂的物质的量之比为1:2 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2KI+O3+H2O═2KOH+I2+O2中,I元素的化合价升高,臭氧中O元素的化合价降低,以此来解答.
解答:
解:A.水中元素的化合价不变,水不是氧化剂也不是还原剂,故A错误;
B.该反应中水不是氧化剂,故B错误;
C.每生成1mol I2,转移的电子数为1mol×2×(1-0)=2mol,故C错误;
D.该反应中KI为还原剂,O3为氧化剂且1 mol O3反应时只有1 mol O原子被还原,则氧化剂与还原剂的物质的量之比为1:2,故D正确;
故选D.
B.该反应中水不是氧化剂,故B错误;
C.每生成1mol I2,转移的电子数为1mol×2×(1-0)=2mol,故C错误;
D.该反应中KI为还原剂,O3为氧化剂且1 mol O3反应时只有1 mol O原子被还原,则氧化剂与还原剂的物质的量之比为1:2,故D正确;
故选D.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
下列反应类型的判断,不正确的是( )
| A、CO2+H2O?H2CO3 化合反应 | ||||
B、Cu(OH)2
| ||||
C、MnO2+2CO
| ||||
| D、NaCl+AgNO3═AgCl↓+NaNO3 复分解反应 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
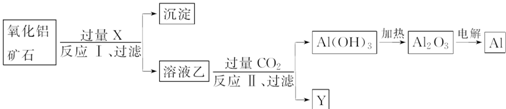
下列说法正确的是( )

下列说法正确的是( )
A、反应Ⅱ为CO2+2AlO
| ||
| B、CO2可以用H2SO4溶液或稀盐酸代替 | ||
| C、制取的铝单质与少量NaOH溶液反应的离子方程式为:Al+3OH-=Al(OH)3↓ | ||
| D、试剂X可以为NaOH溶液,沉淀中含有铁的化合物 |
一定条件下,将5molH2和1molN2充入一密闭容器中,发生反应:N2+3H2?2NH3(各物质均为气态),达到平衡时,H2的转化率不可能是( )
| A、20% | B、35% |
| C、50% | D、65% |
为保护环境、防止污染,下列最理想的燃料是( )
| A、酒精 | B、氢气 | C、汽油 | D、无烟煤 |
电离方程式书写错误的是( )
| A、Al2(SO4)3=2Al3++3SO42- |
| B、HF?H++F- |
| C、H2CO3?2H++CO32- |
| D、Ba(OH)2=Ba2++2OH- |
下列反应的离子方程式书写正确的是( )
| A、氯气和水的反应:C12+H2O═2H++Clˉ+ClOˉ | ||||
| B、向碳酸氢钠溶液中加入过量氢氧化钠溶液:OHˉ+HCO3ˉ=CO2↑+H2O | ||||
| C、氯化铝溶液中滴加过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | ||||
D、惰性电极电解饱和氯化钠溶液:2Clˉ+2H2O
|
下列说法正确的是( )
| A、由极性键构成的分子都是极性分子 |
| B、含非极性键的分子一定是非极性分子 |
| C、极性分子一定含有极性键,非极性分子一定含有非极性键 |
| D、以极性键结合的双原子分子,一定是极性分子 |
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li+I2→2LiI.下列有关说法错误的是( )
| A、放电时化学能转化为电能 |
| B、负极反应为:Li-e→Li+ |
| C、正极反应为:I2+2e→2I- |
| D、电子由正极流向负极 |