题目内容
已知Na2O2中的O为-1价.在 2Na2O2+2CO2═2Na2CO3+O2反应中,
(1) 是还原剂, 是氧化剂.
(2)若转移3mol电子,则产生的氧气的物质的量为 ,在标准状况下的体积为 .
(1)
(2)若转移3mol电子,则产生的氧气的物质的量为
考点:氧化还原反应,氧化还原反应的计算
专题:
分析:由方程式可知反应中只有O元素的化合价发生变化,反应中Na2O2既是氧化剂又是还原剂,结合反应的方程式计算.
解答:
解:(1)只有O元素的化合价发生变化,反应中Na2O2既是氧化剂又是还原剂,故答案为:Na2O2;Na2O2;
(2)由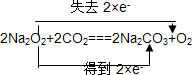 可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,
可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,
故答案为:1.5mol;33.6L.
(2)由
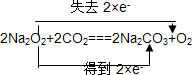 可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,
可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,故答案为:1.5mol;33.6L.
点评:本题考查氧化还原反应,题目难度不大,解答该类题目的关键是能把握元素的化合价的变化,注意结合电子转移方向和数目计算该题.

练习册系列答案
相关题目
某有机物的结构为HO-CH2-CH=CHCH2-COOH,该有机物不可能发生的化学反应是( )
| A、水解反应 | B、酯化反应 |
| C、加成反应 | D、氧化反应 |
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
| A、分子中的C、H、O的个数比为1:2:3 |
| B、该有机物的相对分子质量为28 |
| C、分子中C、H个数比为1:2 |
| D、该分子中肯定不含氧元素 |
某火锅城将正规渠道获得的罂粟壳放入火锅中让顾客食用,下列说法不正确的( )
| A、火锅城的行为违法 |
| B、火锅城欺骗他人吸食毒品 |
| C、吗啡、病毒、海洛因都是毒品 |
| D、罂粟壳是人工合成的毒品 |
玻璃仪器:①烧杯 ②烧瓶 ③试管 ④容量瓶 ⑤量筒.能直接加热的是( )
| A、①③ | B、②③ | C、③ | D、④⑤ |
下列分子中,所有原子都满足最外层为8电子结构的是( )
| A、BF3 |
| B、PCl5 |
| C、HCl |
| D、CF2Cl2 |
硅单质及其化合物在材料领域中一直扮演着主要角色.下列叙述中,正确的是( )
| A、石英可用来制作工艺品 |
| B、硅单质可用来制造太阳能电池 |
| C、硅单质是制造玻璃的主要原料 |
| D、二氧化硅是制造光导纤维的材料 |
下列气体中,无色无味的是( )
| A、Cl2 |
| B、SO2 |
| C、NO2 |
| D、O2 |
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
| A、1 mol苯分子中含有C=C双键数为3NA |
| B、1mol羟基(-OH)所含的电子总数为10NA |
| C、标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA |
| D、5.6g乙烯和丙烯的混合气体中所含碳原子数为0.4NA |