题目内容
20.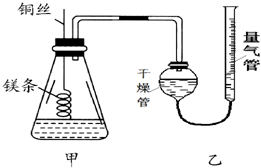 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
①.配制 0.20mol/L的盐酸溶液;
②.用酸式滴定管量取10.00mL 0.20mol/L的盐酸溶液加入锥形瓶中;
③.用电子天平称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为0.024;
④.按上图连接好装置,检查装置的气密性;由量气管向干燥管中加适量的水并读出量气管中水面刻度为V1mL(量气管结构类似碱式滴定管).
⑤.反应结束后待体系温度恢复到室温,读出量气管中水面刻度为V2mL.
根据上述步骤提供的信息回答下列问题:
(1)若用密度为1.25g•cm-3,质量分数为36.5%的浓盐酸配制240mL0.20mol/L的盐酸溶液,浓盐酸的溶质的物质的量浓度为12.5mol/L,需这样的浓盐酸4.00mL.
(2)将上述步骤补充完整:②酸式滴定管;③0.024.
(3)实验步骤⑤中应选用B(填序号)的量气管.
A.20mL B.50mL C.100mL
读数时除恢复到室温外,还要注意调节量气管高度,使量气管内的液面与干燥管内的液面相平.
(4)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的为Vm=(V2-V1)L/mol,若未除去镁条表面的氧化膜,则测量结果偏小(填“偏大”、“偏小”或“无影响”).
分析 (1)根据c浓=$\frac{ρω}{M}×1{0}^{3}$计算浓盐酸的物质的量浓度,容量瓶没有240mL的规格,需要配制250mL,据稀释定律:c浓×V浓=c稀×V稀计算浓盐酸的体积;
(2)②根据酸式滴定管和碱式滴定管的使用要求来选择;
③根据方程式计算完全反应需要的镁的质量;
(3)根据方程式计算完全反应产生氢气的物质的量,再得出在标况下氢气的体积,在同压、同物质的量的条件下,气体的体积随温度升高而增大,$\frac{{V}_{标}}{{V}_{室}}$=$\frac{{T}_{标}}{{T}_{室}}$,算出室温下的体积,再作选择;读数时要保持左右气体压强相等,以减少误差;
(4)忽略水蒸气影响,在该实验条件下测得气体摩尔体积的计算式为Vm=$\frac{V}{n}$;若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小.
解答 解:(1)根据公式计算浓盐酸的物质的量浓度,c浓=$\frac{ρω}{M}×1{0}^{3}$=$\frac{1.25×36.5%}{36.5}×1{0}^{3}$=12.5mol/L,容量瓶没有240mL的规格,需要配制250mL,据稀释定律:c浓×V浓=c稀×V稀,则V浓=$\frac{250mL×0.20mol/L}{12.5mol/L}$=4.00mL,
故答案为:12.5mol/L;4.00;
(2)②题中要求酸的体积10.00 mL较精确,应选酸式滴定管,如用碱式滴定管会腐蚀橡胶管,
故答案为:酸式滴定管;
③Mg+2HCl═MgCl2+H2↑
24g 2 mol
a 0.2mol/L×0.01L
a=0.024 g,
故答案为:0.024;
(3)Mg+2HCl═MgCl2+H2↑
24g 1mol
0.024g n(H2)
完全反应产生氢气的物质的量为n(H2)=0.001mol,在标况下V(H2)=0.001mol×22.4L/mol=0.024L=24mL,在同压、同物质的量的条件下,气体的体积随温度升高而增大,$\frac{{V}_{标}}{{V}_{室}}$=$\frac{{T}_{标}}{{T}_{室}}$,则室温下的体积V室=$\frac{{V}_{标}×{T}_{室}}{{T}_{标}}$=$\frac{24mL×(273+25)K}{273K}$=26mL,应选50mL量筒;读数时要保持左右气体压强相等,以减少误差,故应注意:调节量气管高度,使量气管内的液面与干燥管内的液面相平,
故答案为:B;调节量气管高度,使量气管内的液面与干燥管内的液面相平;
(4)若忽略水蒸气的影响,则在该实验条件下测得气体摩尔体积的计算式为Vm=$\frac{V}{n}$=$\frac{{(V}_{2}-{V}_{1})×1{0}^{-3}L}{0.001mol}$=(V2-V1)L/mol,若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小,
故答案为:(V2-V1)L/mol;偏小.
点评 本题主要考查探究室温下的气体摩尔体积,题目灵活,涉及溶液的配制、实验操作、定量计算等,注意气体摩尔体积的计算要抓住定义进行计算,试题的综合性较强,有一定的难度.

 名校课堂系列答案
名校课堂系列答案| A. | 16O和18O | B. | H2O和D2O | C. | 金刚石和石墨 | D. | 24Mg和24Na |
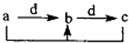 如表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | N2 | NO | NO2 | O2 |
| C | Na2CO3 | NaHCO3 | NaOH | CO2 |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
| A. | 增重30% | B. | 一定增加 | C. | 可能不变 | D. | 减轻30% |
| A. | 高锰酸钾 | B. | H2SO4 | C. | CH3COOH | D. | 重铬酸钾 |


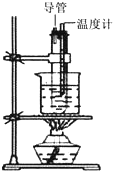 用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:
用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题: ;反应类型:取代反应.
;反应类型:取代反应.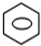 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$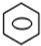 -NO2+H2O
-NO2+H2O ;
;