题目内容
世界上每年铜的产量是八百万吨(8×106t),铜的主要来源之一是由辉铜矿(主要成分是Cu2S),工业上由辉铜矿生产铜的反应是:Cu2S+O2
2Cu+SO2,如果完全采用这种方法生产这八百万吨铜,则每年需要消耗的Cu2S为多少吨?由此得到的二氧化硫在标准状况下体积是多少升?
| ||
考点:化学方程式的有关计算
专题:计算题
分析:根据方程式计算需要Cu2S的质量,计算Cu的物质的量,根据方程式计算生成二氧化碳的物质的量,根据V=nVm计算二氧化硫的体积.
解答:
解:设需要消耗的Cu2S为x,则:
Cu2S+O2
2Cu+SO2
160 128
x 8×106t
x=
=1×107t
8×106t Cu 的物质的量=
=1.25×1011mol,
由方程式可知,n(SO2)=
×1.25×1011mol,故V(SO2)=
×1.25×1011mol×22.4L/mol=1.4×1010L,
答:每年需要消耗的Cu2S为1×107吨,由此得到的二氧化硫在标准状况下体积是1.4×1010升.
Cu2S+O2
| ||
160 128
x 8×106t
x=
| 160×8×106t |
| 128 |
8×106t Cu 的物质的量=
| 8×1012g |
| 64g/mol |
由方程式可知,n(SO2)=
| 1 |
| 2 |
| 1 |
| 2 |
答:每年需要消耗的Cu2S为1×107吨,由此得到的二氧化硫在标准状况下体积是1.4×1010升.
点评:本题考查化学方程式计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙).
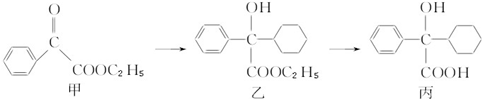
下列说法正确的是( )

下列说法正确的是( )
| A、化合物乙能发生消去反应,且生成的有机物能和Br2发生加成反应 |
| B、化合物丙能和FeCl3溶液发生显色反应 |
| C、化合物甲中的含氧官能团有羰基和酯基 |
| D、化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 |


 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表所示:
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表所示: