题目内容
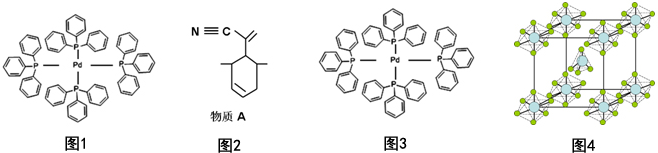
11. 利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是(2)(3)(9)
利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是(2)(3)(9)(1)浓氨水和固体NaOH制NH3
(2)大理石和稀盐酸制CO2
(3)浓硝酸和铜片制NO2
(4)稀硝酸和铜片制NO
(5)浓盐酸和二氧化锰制Cl2
(6)电石和水制C2H2
(7)锌粒和稀硫酸制H2
(8)乙醇和浓硫酸制C2H4
(9)双氧水和二氧化锰制O2.
分析 由装置可知,为固体与液体反应不需要加热制备气体,且气体的密度比空气的密度大,利用向上排空气法收集,以此来解答.
解答 解:(1)浓氨水和固体NaOH制NH3,氨气应选向下排空气法收集,故不选;
(2)大理石和稀盐酸制CO2,符合固体与液体反应不需要加热制备气体,且气体的密度比空气的密度大,利用向上排空气法收集,故选;
(3)浓硝酸和铜片制NO2,符合固体与液体反应不需要加热制备气体,且气体的密度比空气的密度大,利用向上排空气法收集,故选;
(4)稀硝酸和铜片制NO,NO不能利用排空气法收集,故不选;
(5)浓盐酸和二氧化锰制Cl2,需要加热,故不选;
(6)电石和水制C2H2,气体的密度与空气的密度略小,不能利用排空气法收集,应利用排水法,故不选;
(7)锌粒和稀硫酸制H2,但气体的密度比空气的密度小,利用向下排空气法收集,故不选;
(8)乙醇和浓硫酸制C2H4,气体的密度与空气的密度略小,不能利用排空气法收集,应利用排水法,故不选;
(9)双氧水和二氧化锰制O2,符合固体与液体反应不需要加热制备气体,且气体的密度比空气的密度大,利用向上排空气法收集,故选;
故答案为:(2)(3)(9).
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、常见气体的制备原理及收集方法为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
12.铁钉和碳棒用导线连接,浸入稀NaCl溶液中,正极发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
13.下列各组中的反应,属于同一反应类型的是( )
| A. | 1-丙醇制丙烯;丙烯与溴水反应制1,2-二溴丙烷 | |
| B. | 溴乙烷水解制丙醇;丙烯与水反应制丙醇 | |
| C. | 甲苯硝化制对硝基甲苯;甲苯氧化制苯甲酸 | |
| D. | 乙酸和乙醇制乙酸乙酯;苯甲酸乙酯水解制苯甲酸和乙醇 |
16.部分弱电解质的电离平衡常数如下表:
下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| D. | 0.1mol/L的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
20.实验报告中,以下数据合理的是( )
| A. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用pH试纸测定HNO3溶液的pH=3.7 | |
| D. | 用托盘天平称取11.7gNaCl |
1.下列说法不正确的是( )
| A. | 在船舶的外壳装上镁合金或锌块保护钢铁设备被称为牺牲阳极的阴极保护法 | |
| B. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| C. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 | |
| D. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 |
 .
.