题目内容
2.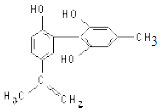 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇 FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入 KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1 mol 该物质分别与浓溴水和 H2反应时最多消耗 Br2和 H2分别为 4 mol、7 mol |
分析 该有机物含有酚羟基,可与溴水发生取代反应,可与高锰酸钾发生氧化反应,含有C=C官能团,可发生加成、氧化反应,结合苯环、乙烯的结构特征判断有机物的空间结构特点,以此解答该题.
解答 解:A.含有2个苯环,且含有碳碳双键,与苯酚结构不同,不是同系物,故A错误;
B.甲基、酚羟基、碳碳双键都可被酸性高锰酸钾氧化,故B错误;
C.从苯环的平面结构及乙烯的平面结构出发,把上述结构分成三部分:右边以苯环为中心8个碳原子共平面,左边以苯环为中心8个碳原子共平面,还有以C=C为中心4个碳原子共平面,上述三个平面可以共平面,故C错误;
D.与浓溴水反应酚类为邻对位上的氢被溴取代,左边苯环邻对位上只有一个H,右边苯环邻对位上有两个H,还有一个C=C与溴水发生加成反应,共消耗4 mol的Br2;两个苯环、一个C=C共消耗7 mol的H,故D正确.
故选D.
点评 本题考查的是由有机物结构推断物质性质,为高频考点,侧重考查学生的分析能力,首先分析有机物的结构简式,找出官能团,根据有机物官能团的性质进行判断,易错点为D,注意有机物空间结构的分析,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列物质中不能由两种单质直接化合得到的是( )
| A. | FeCl3 | B. | Cu2S | C. | SO3 | D. | NH3 |
13.下列反应能用离子方程式OH-+H+=H2O表示的有( )
| A. | 氨水与稀盐酸反应 | B. | H2SO4与Al(OH)3反应 | ||
| C. | 澄清石灰水与稀硝酸反应 | D. | NaOH与CH3COOH溶液反应 |
10.将8.4g铁粉和3.2g硫粉混合均匀,加热到反应完全为止,冷却后加足量盐酸,收集到的气体在标准状况时的体积为( )
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
17.关于下列物质的用途的说法错误的是( )
| A. | 乙二醇可用于配制汽车防冻液 | |
| B. | 部分卤代烃可用作灭火剂 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 甲醛的水溶液(福尔马林)可用于防腐 |
7.表中,陈述I、II均正确且两者间具有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | 除去苯中的苯酚杂质,向其中加入足量的溴水,过滤 | 苯酚与溴水反应生成难溶于水的沉淀,故可过滤除去 |
| B | 醋酸加入到碳酸钠固体中,将产生的气体通入C2H5ONa中,溶液变浑浊 | 可证明酸性:CH3COOH>H2CO3>C2H5OH |
| C | 将CH3CH2Br与NaOH 乙醇溶液共热产生的气体通入溴水中,溶液褪色 | 可证明该反应产生乙烯 |
| D | 氯乙烷中加入NaOH溶液共热,冷却后滴入AgNO3溶液,有白色沉淀生成 | 可证明氯乙烷中有氯元素存在 |
| A. | A | B. | B | C. | C | D. | D |
14.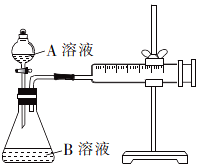 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)该实验探究的是H2C2O4的浓度对反应速率的影响.实现该实验目的还欠缺的仪器:秒表.比较①、②两组化学反应速率大小的方法是测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间.
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
(3)若要研究催化剂对化学反应速率的影响,则应对比实验Ⅰ、Ⅱ(填序号,下同);若要研究温度对化学反应速率的影响,则应对比实验Ⅰ、Ⅲ.
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
(2)该实验探究的是H2C2O4的浓度对反应速率的影响.实现该实验目的还欠缺的仪器:秒表.比较①、②两组化学反应速率大小的方法是测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间.
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
11.有机物M是合成某药品的中间体,结构简式如图所示.下列说法错误的是( )


| A. | M能发生酯化、加成、氧化反应 | |
| B. | 用碳酸氢钠不能检验M分子中存在羧基 | |
| C. | M的分子式为C8H8O4 | |
| D. | M的苯环上一氯代物有2种 |
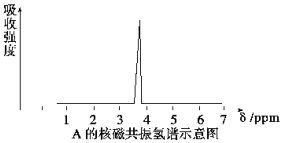 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).