题目内容
10.将8.4g铁粉和3.2g硫粉混合均匀,加热到反应完全为止,冷却后加足量盐酸,收集到的气体在标准状况时的体积为( )| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
分析 加热发生反应为Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中,无论铁过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,再根据V=nVm计算生成气体的体积.
解答 解:发生反应为Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中,无论铁过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,
所以生成气体的总物质的量为:n(气体)=n(Fe)=$\frac{8.4g}{56g/mol}$=0.15mol,标准状况下该气体体积为:0.15mol×22.4L/mol=3.36L,
故选C.
点评 本题考查化学方程式的计算,题目难度中等,明确发生反应实质为解答关键,注意利用方程式判断生成气体与原混合物中Fe的物质的量相等,可避免加热过程中的过量计算的繁琐,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应.据此,下列判断或说法中正确的是( )
| A. | 在相同的条件下,红磷比白磷稳定 | |
| B. | 在相同的条件下,白磷比红磷稳定 | |
| C. | 红磷和白磷的化学性质相同 | |
| D. | 红磷容易发生自燃而白磷则不会自燃 |
1.下列物质属于合金的是( )
| A. | 硬铝 | B. | 石墨 | C. | 黄金 | D. | 金刚石 |
18.钢铁制品发生析氢和吸氧腐蚀时,不同的是( )
| A. | 电解质溶液 | B. | 负极材料 | C. | 正极反应 | D. | 负极反应 |
5.在下水管道里,因某些有机物的腐败,常会产生一种有臭鸡蛋气味的有害气体,该气体是( )
| A. | CO | B. | CH4 | C. | SO3 | D. | H2S |
2.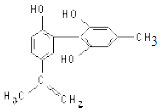 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇 FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入 KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1 mol 该物质分别与浓溴水和 H2反应时最多消耗 Br2和 H2分别为 4 mol、7 mol |