题目内容
1.为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空: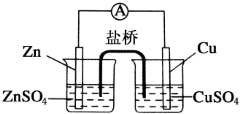
(1)此装置工作时,可以观察到的现象是:Zn电极逐渐变细,Cu电极逐渐变粗,电池总反应式为:Zn+Cu2+═Zn2++Cu.
(2)电池工作时,电子从Zn经过导线流向Cu,硫酸锌溶液中SO42-向左移动,硫酸铜溶液中SO42-向左移动.
(3)此盐桥内为饱和KCl溶液,盐桥是通过离子移动来导电的.在工作时,K+移向硫酸铜溶液,Cl-移向硫酸锌溶液.
(4)在电池中,电流从Cu经导线流向Zn,再经硫酸锌溶液、盐桥、硫酸铜溶液流回铜电极.
分析 (1)原电池中负极失电子,正极上溶液中的铜离子得电子,电池总反应为铜离子与锌之间的置换反应;
(2)原电池中电子从负极流向正极,阴离子向负极移动,阳离子向正极移动;
(3)盐桥是通过离子移动导电,阴离子向负极移动,阳离子向正极移动;
(4)原电池中电流从正极流向负极,经过溶液再流回正极.
解答 解:(1)原电池中负极失电子,锌失电子作负极,锌电极逐渐变细,正极上溶液中的铜离子得电子生成铜单质,所以铜电极逐渐变粗,电池总反应为Zn+Cu2+═Zn2++Cu;
故答案为:Zn电极逐渐变细;Cu电极逐渐变粗;Zn+Cu2+═Zn2++Cu;
(2)原电池中电子从负极流向正极,即电子从Zn电极流出,经过导线流向Cu电极;溶液中阴离子向负极移动,即硫酸锌溶液中SO42-向左移动,硫酸铜溶液中SO42-向左移动;
故答案为:Zn;Cu;左;左;
(3)盐桥内为饱和KCl溶液,盐桥是通过离子移动导电,盐桥中K+向硫酸铜溶液移动,Cl-向硫酸锌溶液移动;
故答案为:离子;硫酸铜溶液;硫酸锌溶液;
(4)在电池中,电流从正极Cu流出,经过导线流向负极锌,再经过硫酸锌溶液、盐桥、硫酸铜溶液,再流回正极铜;
故答案为:Cu;Zn;硫酸锌溶液;硫酸铜溶液.
点评 本题考查原电池原理,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法,注意把握正负极的判断和电子、电流和离子的移动方向.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列反应中,不属于四种基本类型反应,但属于氧化还原反应的是( )
| A. | 2CO+O2═2CO2 | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | 2KClO3═2KCl+3O2↑ | D. | Fe2O3+3CO═2Fe+3CO2 |
13.下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
| A. | Cu2+(Fe3+):足量的Fe粉 | B. | MgO(Al2O3):足量的Ba(OH)2溶液 | ||
| C. | NaHCO3溶液(Na2CO3):足量的CO2 | D. | CO2(HCl):饱和NaHCO3溶液 |
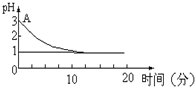 关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:
关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点: