题目内容
4.下列说法正确的是( )| A. | 对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 | |
| B. | 2MnO(s)+O2(g)═2MnO2(s),该反应在低温下能自发进行,则其△H<0 | |
| C. | 用干燥的pH试纸测得某氯水的pH=3.1 | |
| D. | 航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀 |
分析 A.焓变等于断键吸收的能量减去成键释放的能量;
B.△H-T△S<0的反应可自发进行;
C.氯水中含HClO,具有漂白性;
D.水面下的部分腐蚀,钢铁与海水构成原电池.
解答 解:A.H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol,为放热反应,则破坏旧化学键吸收的能量比形成新化学键释放的能量少,故A错误;
B.2MnO(s)+O2(g)═2MnO2(s)的△S<0,△H-T△S<0的反应可自发进行,该反应在低温下能自发进行,则其△H<0,故B正确;
C.氯水中含HClO,具有漂白性,不能利用试纸测定氯水的pH,应选pH计,故C错误;
D.水面下的部分腐蚀,钢铁与海水构成原电池,易发生电化学腐蚀,故D正确;
故选BD.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、反应进行方向、pH测定、电化学腐蚀为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
15.硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示.
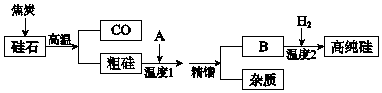
(1)从硅石中得到粗硅的化学方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅含有的杂质有铝、铁等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,该反应中的氧化剂是碳.
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,温度应控制的范围是a(填序号).
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是FeCl3、AlCl3.
(4)若A是HCl,B是SiHCl3,生产过程中可循环利用的物质是HCl.

(1)从硅石中得到粗硅的化学方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅含有的杂质有铝、铁等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,该反应中的氧化剂是碳.
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,温度应控制的范围是a(填序号).
| 物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
| 熔点/℃ | -70 | -128.2 | 306 | -- |
| 沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
则精馏分离出的杂质成分是FeCl3、AlCl3.
(4)若A是HCl,B是SiHCl3,生产过程中可循环利用的物质是HCl.
12.下列有关化学用语正确的是( )
| A. | 氮气分子的结构式N≡N | B. | 钾离子的电子式:K | ||
| C. | 硫原子的结构示意图 | D. | 二氧化硅的分子式:SiO2 |
19.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应的△H>0,吸热反应的△H<0 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
9.铅蓄电池工作一段时间后,需要充电,则铅蓄电池的负极在充电时( )
| A. | 做电解池的阴极,和外加电源的负极相连 | |
| B. | 做电解池的阴极,和外加电源的正极相连 | |
| C. | 做电解池的阳极,和外加电源的负极相连 | |
| D. | 做电解池的阳极,和外加电源的正极相连 |
13.N4最初由罗马大学的Fulvio Cacace及其同事发现,向一恒容、绝热的密闭容器中加入一定量的N2和H2,发生如下反应:①N2(g)+3H2(g)?2NH3(g)△H1=-92.2kJ•mol;②4NH3(g)?N4(g)+6H2(g)△H2=+1066.4kJ•mol;③2N2(g)?N4(g)△H3.以下有关说法正确的是( )
| A. | 反应③为放热反应 | |
| B. | 当容器内湿埋不再变化时,上述各反应均达到化学平衡状态 | |
| C. | 当混合气体的密度不再变化时,上述各反应均达到化学平衡状态 | |
| D. | 若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=2K1•K2 |
8.下列说法正确的是( )
| A. | 苯萃取碘水中的I2,分出水层的操作为从上口倒出 | |
| B. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 配制245mL0.1 mol•L-1的NaOH溶液,需要245mL容量瓶 |