题目内容
11. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:A的单质是密度最小的物质;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C的原子最外层电子数是其内层电子数的三倍;D与B同周期,该周期中D的简单离子半径最小;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分;F元素最高正价与最低负价的代数和为4.
(1)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O.
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示)S2->Cl->Al3+.
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为30%.
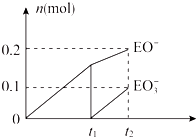
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.t2时反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(5)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH→CH3CH2ONa+H2↑.
分析 短周期元素中,A的单质是密度最小的物质,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则B为Na;C的原子最外层电子数是其内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B(Na)同周期,该周期中D的简单离子半径最小,则D为Al;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,则E为Cl,Y为NaClO;F元素最高正价与最低负价的代数和为4,则F为S元素,据此解答.
解答 解:短周期元素中,A的单质是密度最小的物质,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则B为Na;C的原子最外层电子数是其内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B(Na)同周期,该周期中D的简单离子半径最小,则D为Al;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,则E为Cl,Y为NaClO;F元素最高正价与最低负价的代数和为4,则F为S元素.
(1)两种均含H、Na、O、S四种元素的化合物为NaHSO4、NaHSO3,在溶液中相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(3)向Fe和Al单质组成的混合物中,加入足量稀硫酸,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体为氧化铁,经称量发现氧化铁的质量和原混合物的质量恰好相等,所以铝的质量相当于氧元素的质量,则原混合物中Al单质的质量分数等于氧化铁中O元素的质量分数=$\frac{16×3}{56×2+16×3}$×100%=30%,
故答案为:30%;
(4)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
故答案为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(5)H、Na形成的化合物NaHBA在有机合成中用途很广泛,它可以夺取很多化合物中的质子而生成相应的钠的化合物,它与乙醇反应的化学方程式为:NaH+CH3CH2OH→CH3CH2ONa+H2↑,
故答案为:NaH+CH3CH2OH→CH3CH2ONa+H2↑.
点评 本题考查结构性质位置关系应用,正确推断元素是解题关键,(3)中关键是理解氧化铁中的氧元素质量相当于铝元素的质量,侧重考查学生对知识的迁移运用能力考查,难度中等.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
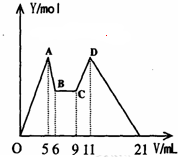 在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )| A. | 9mL | B. | 7.5mL | C. | 7ml | D. | 6mL |
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| D. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
| A. | NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥 | |
| B. | N2+3H2$?_{高温、高压}^{催化剂}$2NH3,用烧碱进行干燥 | |
| C. | 加热浓氨水,气体用碱石灰干燥 | |
| D. | 加热NH4HCO3,气体用P2O5干燥 |
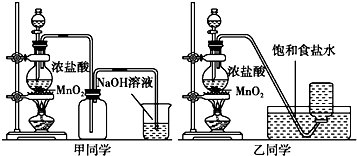
请回答:
(1)写出实验室制备氯气的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)对于乙同学的实验装置,若要停止实验,其操作顺序是②③①.
①停止加热 ②取出集气瓶盖好 ③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验.实验操作、现象、结论记录如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
A.CaC12和次氯酸B.浓盐酸NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四种试剂中D组试剂符合实际,且Cl的原子利用率最高.试写出这个反应的化学方程式NaCl+NaClO+H2SO4═Na2SO4+H2O+Cl2↑(产物中Na2SO4也可写成NaHSO4).
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因:K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
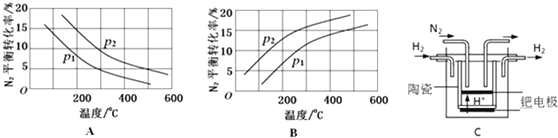
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是р2>р1.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
| 选项 | 实验目的 | 操作或现象 |
| A | 检验甲酸溶液中是否含有甲醛 | 向溶液中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,有红色沉淀产生 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖是否已水解 | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热 |
| D | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向上层清液中加稀HNO3酸化,再滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |