题目内容
 可逆反应mA(g)+nB(g)?eC(g)+fD(g),当其它条件不变时,C的百分含量与温度、压强关系如图1,图2所示,下列说法正确的是( )
可逆反应mA(g)+nB(g)?eC(g)+fD(g),当其它条件不变时,C的百分含量与温度、压强关系如图1,图2所示,下列说法正确的是( )| A、达平衡后,使用催化剂C的百分含量变大 |
| B、达平衡后升温,平衡左移 |
| C、方程式系数m+n>e+f |
| D、达平衡后,增加A的量有利于平衡向正反应方向移动 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:T2达到平衡时间短,温度较高,而C%含量低,则正反应方向放热,P2达到平衡时间短,压强较大,而C%含量低,则m+n<e+f,催化剂不影响平衡移动,据此判断.
解答:
解:A、催化剂只影响反应速率,不影响平衡移动,故A错误;
B、T2达到平衡时间短,温度较高,而C%含量低,正反应方向放热,升温平衡逆向移动,故B正确;
C、P2达到平衡时间短,压强较大,而C%含量低,则m+n<e+f,故C错误;
D、增大A的量,反应物浓度增大平衡正向移动,故D正确;
故选BD.
B、T2达到平衡时间短,温度较高,而C%含量低,正反应方向放热,升温平衡逆向移动,故B正确;
C、P2达到平衡时间短,压强较大,而C%含量低,则m+n<e+f,故C错误;
D、增大A的量,反应物浓度增大平衡正向移动,故D正确;
故选BD.
点评:本题考查化学平衡图象、影响平衡的因素、影响因素等,难度不大,注意掌握平衡移动原理,根据图象判断温度和压强对平衡移动的影响.

练习册系列答案
相关题目
 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )| A、反应一定是放热反应 |
| B、达到平衡时的转化率大小为:b>a>c |
| C、若T2<T1,则反应一定是吸热反应 |
| D、b点时,平衡体系中A、B原子数之比接近1:3 |
下列有机物能发生水解反应生成醇的是( )
| A、CH3CH2Br |
| B、CH2Cl2 |
| C、CHCl3 |
| D、C6H5Br |
下列有关叙述正确的是( )
| A、液体氯化氢、液氮、液氯都是电解质 |
| B、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、NaCl为离子化合物,HCl为共价化合物,它们的判断方法是看熔融状态是否导电 |
| D、BaSO4的水溶液不易导电,故BaSO4是弱电解质 |
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A B和C则( )
| A、平衡向正反应方向移动 |
| B、平衡向逆反应方向移动 |
| C、平衡不发生移动 |
| D、增大 |
已知:在同一个反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I2按下式反应:2KClO3+I2═2KIO3+Cl2,下列判断正确的是( )
| A、该反应属于置换反应 |
| B、氧化性:I2>KClO3 |
| C、还原性:KClO3>I2 |
| D、还原剂为I2,氧化剂为KClO3 |
下列微粒可以在水中大量共存的是( )
| A、C6H12O6(葡萄糖)、Ag(NH3)2+、NO3-、OH- |
| B、AgI、Cl-、SO42-、NH4+ |
| C、Fe3+、K+、ClO-、NO3- |
| D、H2O2、Cl-、SO42-、Fe3+ |
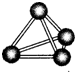 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )| A、N4分子属于一种新型的化合物 |
| B、N4分子中只含有非极性键 |
| C、1 mol N4分子所含共价键数为4NA |
| D、N4沸点比P4(白磷)高 |
 某化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮.
某化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮.