题目内容
已知:在同一个反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I2按下式反应:2KClO3+I2═2KIO3+Cl2,下列判断正确的是( )
| A、该反应属于置换反应 |
| B、氧化性:I2>KClO3 |
| C、还原性:KClO3>I2 |
| D、还原剂为I2,氧化剂为KClO3 |
考点:氧化还原反应
专题:
分析:2KClO3+I2═2KIO3+Cl2中,Cl元素的化合价降低,I元素的化合价升高,以此来解答.
解答:
解:A.题给反应符合置换反应定义,即一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应,故A正确;
B.Cl元素的化合价由+5→0,I元素的化合价由0→+5,KClO3为氧化剂,其氧化性大于I2,故B错误;
C.Cl元素的化合价由+5→0,I元素的化合价由0→+5,因此I2为还原剂,其还原性大于KClO3,故C错误;
D.由B、C可知,还原剂为I2,氧化剂为KClO3,故D正确;
故选AD.
B.Cl元素的化合价由+5→0,I元素的化合价由0→+5,KClO3为氧化剂,其氧化性大于I2,故B错误;
C.Cl元素的化合价由+5→0,I元素的化合价由0→+5,因此I2为还原剂,其还原性大于KClO3,故C错误;
D.由B、C可知,还原剂为I2,氧化剂为KClO3,故D正确;
故选AD.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
将2.7gAl与100ml2mol/LH2SO4溶液充分反应后,再慢慢滴入25ml4mol/LNaOH溶液,其结果是( )
| A、所得溶液的pH为7 |
| B、得到澄清透明的溶液 |
| C、取少量所得溶液,加NaHC03,无明显现象发生 |
| D、另取少量所得溶液,加入几滴NaOH溶液,有白色沉淀 |
 可逆反应mA(g)+nB(g)?eC(g)+fD(g),当其它条件不变时,C的百分含量与温度、压强关系如图1,图2所示,下列说法正确的是( )
可逆反应mA(g)+nB(g)?eC(g)+fD(g),当其它条件不变时,C的百分含量与温度、压强关系如图1,图2所示,下列说法正确的是( )| A、达平衡后,使用催化剂C的百分含量变大 |
| B、达平衡后升温,平衡左移 |
| C、方程式系数m+n>e+f |
| D、达平衡后,增加A的量有利于平衡向正反应方向移动 |
13C-NMR(核磁共振)可用于含碳化合物的结构分析,有关13C的说法正确的是( )
| A、质子数为6 |
| B、电子数为13 |
| C、中子数为6 |
| D、质量数为6 |
某气体物质质量为6.4g,含有6.02×1022个分子,则该气体的相对分子质量为( )
| A、64 | B、32 | C、96 | D、32 |
下列烷烃中,常温下呈气态的是( )
| A、十七烷 | B、正已烷 |
| C、异丁烷 | D、正戊烷 |


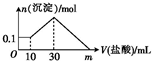 某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )
某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )