题目内容
医学土常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
(1)配平以下离子方程式,并填上所需的微粒.
+ MnO4-+ H2C2O4→ CO2+ Mn2++
(2)该反应中的还原剂是 .
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为 .
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4 溶液,反应生成CaC2O4沉淀,将押淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定.
①稀硫酸溶解CaC2O4沉淀的化学方程式是
②溶解沉淀时 (能或不能)用原因是 ;若选择HNO3溶解沉淀,则结果可能 (填“偏大”“偏小”或“不变〃).
③滴定时,根据现象 ,即可确定反应达到终点.
(1)配平以下离子方程式,并填上所需的微粒.
(2)该反应中的还原剂是
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4 溶液,反应生成CaC2O4沉淀,将押淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定.
①稀硫酸溶解CaC2O4沉淀的化学方程式是
②溶解沉淀时
③滴定时,根据现象
考点:难溶电解质的溶解平衡及沉淀转化的本质,氧化还原反应方程式的配平
专题:
分析:(1)根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;
(2)失电子化合价升高的反应物是还原剂;
(3)根据高锰酸钾和转移电子之间的关系式计算;
(4)①草酸钙和硫酸反应生成硫酸钙和草酸;
②HCl具有还原性,能被酸性高锰酸钾溶液氧化;
③当高锰酸根离子不被氧化时,溶液由无色变为浅紫红色,说明达到滴定终点.
(2)失电子化合价升高的反应物是还原剂;
(3)根据高锰酸钾和转移电子之间的关系式计算;
(4)①草酸钙和硫酸反应生成硫酸钙和草酸;
②HCl具有还原性,能被酸性高锰酸钾溶液氧化;
③当高锰酸根离子不被氧化时,溶液由无色变为浅紫红色,说明达到滴定终点.
解答:
解:(1)根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,所以MnO4-、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O,故答案为:6H+;2;5;10;2;8H2O;
(2)失电子化合价升高的反应物H2C2O4是还原剂,故答案为:H2C2O4;
(3)根据MnO4----5e-得,反应转移了0.4mol电子,则消耗KMnO4的物质的量=
=0.08mol,故答案为:0.08;
(4)①草酸钙和硫酸反应生成硫酸钙和草酸,反应方程式为CaC2O4+H2SO4=CaSO4+H2C2O4,故答案为:CaC2O4+H2SO4=CaSO4+H2C2O4;
②HCl具有还原性,能被酸性高锰酸钾溶液氧化而造成误差,所以不能用盐酸代替;硝酸能够氧化草酸根,导致测定结果偏低,故答案为:不能;高锰酸钾会氧化氯离子;偏小;
③当高锰酸根离子不被氧化时,溶液由无色变为浅紫红色,说明达到滴定终点,故答案为:滴入最后一滴KMnO4,溶被由无色变为浅紫红色且半分钟内不褪色.
(2)失电子化合价升高的反应物H2C2O4是还原剂,故答案为:H2C2O4;
(3)根据MnO4----5e-得,反应转移了0.4mol电子,则消耗KMnO4的物质的量=
| 0.4mol |
| 5 |
(4)①草酸钙和硫酸反应生成硫酸钙和草酸,反应方程式为CaC2O4+H2SO4=CaSO4+H2C2O4,故答案为:CaC2O4+H2SO4=CaSO4+H2C2O4;
②HCl具有还原性,能被酸性高锰酸钾溶液氧化而造成误差,所以不能用盐酸代替;硝酸能够氧化草酸根,导致测定结果偏低,故答案为:不能;高锰酸钾会氧化氯离子;偏小;
③当高锰酸根离子不被氧化时,溶液由无色变为浅紫红色,说明达到滴定终点,故答案为:滴入最后一滴KMnO4,溶被由无色变为浅紫红色且半分钟内不褪色.
点评:本题考查物质含量的测定、氧化还原反应等知识点,侧重考查基本概念、基本理论,根据转移电子守恒、原子守恒配平方程式,注意有机物中C元素化合价的判断方法,题目难度中等.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
现用pH=3的CH3COOH溶液和pH=11的NaOH溶液各V mL,进行中和滴定,当滴定到pH=7时,锥形瓶内溶液的体积为(滴定前后溶液未稀释、总体积不变)( )
| A、等于2V mL |
| B、小于2V mL |
| C、大于2V mL |
| D、无法确定 |
下列有关实验原理或实验操作正确的是( )
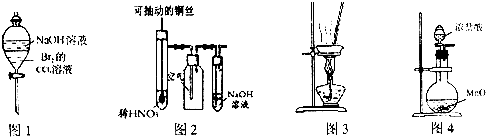

| A、图1装置可以用于除去溶解在CCl4中的Br2 |
| B、图2所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| C、用图3装置在蒸发皿中灼烧CuSO4?5H2O晶体以除去结晶水 |
| D、实验室常用图4装置制取少量氯气 |
 某有机化合物的结构简式如图所示:关于该化合物的下列说法正确的是( )
某有机化合物的结构简式如图所示:关于该化合物的下列说法正确的是( )| A、该有机物分子式C15H14 |
| B、完全燃烧时只有二氧化碳和水两种产物 |
| C、分子中苯环上连有羟基属于酚 |
| D、由于含有氧元素不是有机物 |
 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.