题目内容
下列说法不正确的是( )
| A、分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体 |
| B、KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++SO42- |
| C、利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体 |
| D、氯气可用于自来水的消毒 |
考点:分散系、胶体与溶液的概念及关系,电离方程式的书写,胶体的重要性质
专题:离子反应专题,溶液和胶体专题
分析:A.分散质粒子的直径介于1-100nm,1nm=10-9m;
B.原子个数、电荷均不守恒;
C.丁达尔效应是胶体的特性,可以用来鉴别胶体和溶液;
D.氯气与水反应生成具有强氧化性的次氯酸,可以使蛋白质变性.
B.原子个数、电荷均不守恒;
C.丁达尔效应是胶体的特性,可以用来鉴别胶体和溶液;
D.氯气与水反应生成具有强氧化性的次氯酸,可以使蛋白质变性.
解答:
解:A.分散质粒子的直径介于1-100nm,1nm=10-9m,1-100nm即10-9~10-7m,故A正确;
B.KAl(SO4)2在水溶液中电离方程式为:KAl(SO4)2═K++Al3++2SO42-,故B错误;
C.丁达尔效应是胶体的特性,可以用来鉴别胶体和溶液,故C正确;
D.氯气与水反应生成具有强氧化性的次氯酸,可以使蛋白质变性,所以氯气可用于自来水的消毒,故D正确;
故选:B.
B.KAl(SO4)2在水溶液中电离方程式为:KAl(SO4)2═K++Al3++2SO42-,故B错误;
C.丁达尔效应是胶体的特性,可以用来鉴别胶体和溶液,故C正确;
D.氯气与水反应生成具有强氧化性的次氯酸,可以使蛋白质变性,所以氯气可用于自来水的消毒,故D正确;
故选:B.
点评:本题考查了胶体的本质特征和性质、氯气的性质、电离方程式的书写,属于对课本基础知识的考查,题目难度不大,注意书写电离方程式时应遵循原子个数、电荷数守恒.

练习册系列答案
相关题目
将0.1mol镁铝合金(Mg17Al12)完全溶解于1.2L 6mol/L的盐酸中,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10mol/L的氨水至少( )
| A、0.56L |
| B、0.70L |
| C、0.72L |
| D、0.84L |
以下记录的数据不符合实验事实的是( )
| A、用量筒量取3.3mL蒸馏水 |
| B、用广泛pH试纸测得某溶液的pH为7.2 |
| C、用滴定管量取20.00mL NaOH溶液 |
| D、用电子天平称取2.100g NaCl固体 |
下列说法正确的是( )
| A、糖类、蛋白质、油脂在一定条件下均能发生水解反应 |
| B、在油脂完全皂化后的混合物中加入热的饱和食盐水,搅拌,混合物上下分层,上层是固体肥皂 |
| C、在苯中加入溴水,充分震荡,所得液体显无色 |
| D、分子式是C2H4O2的有机物一定能与碳酸钠反应而放出气体 |
能形成高分子化合物的反应类型是( )
| A、消去反应 | B、复分解反应 |
| C、置换反应 | D、聚合反应 |
下列反应属于吸热反应的是( )
| A、稀硫酸与氢氧化钾溶液反应 |
| B、氢氧化钡晶体与氯化铵晶体研磨搅拌的反应 |
| C、锌与稀硫酸的反应 |
| D、生石灰变成熟石灰的反应 |
下列有机反应表达错误的是( )
A、CH4+Cl2
| |||
| B、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
C、
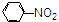 | |||
D、nCH2=CH2
 |
下列有关物理量相应的单位表达中,错误的是( )
| A、气体摩尔体积L/g |
| B、摩尔质量g/mol |
| C、物质的量浓度mol/L |
| D、物质的量 mol |
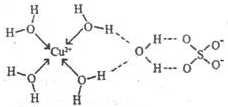 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.