题目内容
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | $\frac{{K}_{w}}{c(O{H}^{-})}$=1×10-13mol•L-1的溶液中:Na+、K+、AlO2-、NO3- | |
| B. | 含有大量Fe3+的溶液中:NH4+、I-、Cl-、K+ | |
| C. | pH=7的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 0.1mol•L-1Na2SO3的溶液中:H+、Ca2+、Fe2+、Cl- |
分析 A.$\frac{{K}_{w}}{c(O{H}^{-})}$=1×10-13mol•L-1的溶液,显碱性;
B.离子之间发生氧化还原反应;
C.pH=7的溶液,显中性;
D.离子之间反应生成沉淀、气体或水.
解答 解:A.$\frac{{K}_{w}}{c(O{H}^{-})}$=1×10-13mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.I-、Fe3+发生氧化还原反应,不能共存,故B错误;
C.pH=7的溶液,显中性,不能大量存在NH4+、Al3+,均水解显酸性,故C错误;
D.H+、Ca2+、Fe2+均与SO32-反应,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
18.将可能混有下列一种物质的硫酸铵样品12克,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.48L(标准状况),则该样品内不可能含有的物质是( )
| A. | 碳酸氢铵 | B. | 亚硫酸铵 | C. | 溴化铵 | D. | 氯化铵 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使淀粉-KI溶液变蓝的溶液:H+、NH4+、Fe2+、Br- | |
| B. | 滴入酚酞呈红色的溶液:Na+、Ca2+、CH3COO-、Cl- | |
| C. | 滴入苯酚显紫色的溶液:Mg2+、NH4+、Cl-、SCN- | |
| D. | 滴入甲基橙呈红色的溶液:K+、Na+、HCO3-、NO3- |
16.下列指定反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 向氨水中通入过量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| C. | 用MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO43-+3Cl-+5H2O |
3.下列有关化学用语表示正确的是( )
| A. | 碳基硫的电子式: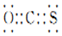 | |
| B. | 乙醛分子的比例模型: | |
| C. | 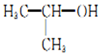 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 氢化钠与重水反应的化学方程式:NaH+D2O═NaOH+D2↑ |
13.下列有关物质的性质与用途具有对应关系的是( )
| A. | 医用酒精能使蛋白质变性,可用于消毒杀菌 | |
| B. | SiO2有很好的折光率,可以用来做半导体材料 | |
| C. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 | |
| D. | 氯化铝是强电解质,可电解其水溶液获得金属铝 |
20.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | Y元素在元素周期表中的位置是第2周期第V族 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 13g苯和乙炔(C2H2)的混合物中含有的碳原子数为NA | |
| B. | 过量铁与标准状况下5.6LCl2充分反应,转移电子数为0.75NA | |
| C. | 0.5mol乙烷中含有的共价键数为3NA | |
| D. | 2L0.5mol/L的Na2CO3溶液中含有的CO32-数目为NA |



