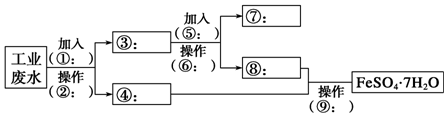
题目内容
17.下列将饱和碘水中的碘单质分离出来的实验操作说法正确的是( )| A. | 使用萃取的方法,并选用酒精作萃取剂 | |
| B. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯中 | |
| D. | 从分液漏斗中分离出的就是纯净的碘单质 |
分析 A.酒精与水互溶;
B.分液漏斗有塞子、活塞;
C.分液时,避免上下层液体混合;
D.从分液漏斗中分离出碘的有机溶液.
解答 解:A.酒精与水互溶,不能作萃取剂,故A错误;
B.分液漏斗有塞子、活塞,使用前先检验其是否漏液,不漏液可使用,故B正确;
C.分液时,避免上下层液体混合,则下层液体从分液漏斗下口放出后,再将上层液体从上口倒出,故C错误;
D.从分液漏斗中分离出碘的有机溶液,为混合物,然后蒸馏分离出碘,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、萃取与蒸馏实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
16.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色澄清透明溶液中:H+、Cu2+、SO42-、Cl- | |
| B. | 0.1 mol•L-1AlCl3溶液中:H+、Na+、Cl-、SO42- | |
| C. | pH=13的溶液中:NH4+、K+、NO3-、HCO3- | |
| D. | c((OH-)<$\sqrt{{K}_{w}}$的溶液:Ca2+、Fe2+、NO3-、ClO- |
8.下列反应中属于氧化还原反应,但水既不做氧化剂,又不做还原剂的是( )
| A. | ICl+H2O=HCl+HIO | B. | 2K+2H2O=2KOH+H2↑ | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2Na2O2+2H2O=4NaOH+O2 |
5.一种元素与另一种元素的本质区别是( )
| A. | 相对原子质量不同 | B. | 质子数不同 | ||
| C. | 中子数不同 | D. | 电子数不同 |
2.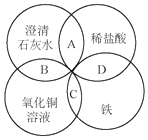 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HCl═H2O+Cl- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Fe+Cu2+═Cu+Fe2+ | D. | Fe+2H+═Fe3++2H2↑ |
9.几种短周期元素的原子半径及某些化合价见表,下列说法不正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | 常温下B元素的单质能与K单质反应 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质存在同素异形体 | |
| D. | J在DB2中燃烧生成B元素的单质 |
6.某种医药中间体X,其结构简式如图.下列有关该化合物说法正确的是( )
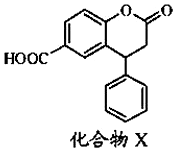

| A. | X的分子式为C15H10O4 | |
| B. | 分子中有3种含氧官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
14.下面列出了电解不同物质的电极反应式,其中错误的是( )
| A. | 以惰性电极电解饱和食盐水阴极:Na++e-═Na | |
| B. | 用铜电极电解CuSO4溶液)阳极:Cu═Cu2++2e- | |
| C. | 以惰性电极电解熔融NaCl阴极:Na++e-═Na | |
| D. | 以惰性电极电解NaOH溶液阳极:4OH-═2H2O+O2↑+4e- |